ハロゲンの性質でホンマに頭がぐちゃぐちゃになるのが、ハロゲン化銀の所ですよね!
ハロゲン化銀の性質は丸暗記するには複雑です。
フッ化銀だけは水に溶けるヨウ化銀はアンモニア水に溶けないとか、ホンマに複雑で丸暗記で正確におぼえるってかなりしんどいです。なのできっちり理解して学んでいきましょう!
目次
今回の激ポイント
今回の話のポイントは、もう何と言っても電気陰性度が関わってくる。
なので、電気陰性度をわかっていないと、この記事で迷宮入りすることになる。
よって必ず電気陰性度とは何かを理解しておいてほしい!
ハロゲン化銀とは?
ハロゲン化銀とはその名の通り、ハロゲン+銀のイオン結晶のことです。
普通イオン結晶というのは水に溶けます。しかし、銀のイオン化傾向が小さいことによって色々と面白い性質が現れます。
「イオン化傾向を知らない人はこちら」
陽イオンになりやすさというのは、自分の電子が要らないってことだよね。てことは、
イオン化傾向が大きい=イオン化エネルギーが小さい(電子を奪うのが容易)=電気陰性度が小さい
と言えるよね!
そして今回の銀みたいにイオン化傾向が小さいということは、イオン化エネルギーが大きくて電気陰性度が大きいということだよね!
今言ったことがパッパとワカラヘンとなかなか今回の話を理解できひんから、今ココで詰まっちゃった人はやっぱりもう一回これ読んどこう!
ハロゲン化銀で入試に必要なのは、
フッ化銀(AgF)、塩化銀(AgCl)、臭化銀(AgBr)、ヨウ化銀(AgI)の4つです!
このハロゲンも電気陰性度が違います。なぜなら、F→Cl→Br→Iとどんどん原子半径が大きくなります。
すると、最外殻の電子を惹き付ける力がF>Cl>Br>Iになります。だから、電気陰性度もF>Cl>Br>Iの順番です。
これがこれ以降のハロゲン化銀にかなり影響してきます。
なぜハロゲン化銀の中でフッ化銀だけが水に溶けるのか?
ハロゲン化銀の水溶性ですが、これは電気陰性度が深く絡んできます。
結論から言うと、なんとフッ化銀だけは水に溶けてそれ以外の塩化銀、臭化銀、ヨウ化銀は水に溶けずに沈殿します。
水に溶けやすいかどうか?というのはコチラの記事で書いています。
簡単に言うと、極性分子である水
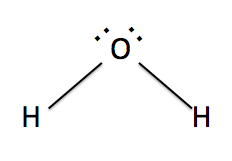
に溶けやすいのは極性分子なのです。そして、この極性が生じるのは、A-Bという結合があった場合、AとBの電気陰性度の差がデカければ、極性が生じます。
『イオン結合・金属結合は元々は共有結合?』の記事でも書きましたが、イオン結合というのは、非金属と金属の結合ですが、
非金属が電気陰性度が大きく、金属が電気陰性度が小さく極性がかなり大きくなっている物をイオン結合と言うのでした。
だから、イオン結晶というのは、基本的に水に溶けます。
しかし、
今回のイオン結晶、ハロゲン化銀は、銀のせいで話が狂ってきます。というのも銀も電気陰性度が大きいのです。
銀の電気陰性度が大きいせいで、Cl、Br、Iとは電気陰性度の差が小さくなってしまうのです。
すると、極性がなくなり、極性分子の水に溶けなくなるのです!
ここで今回の登場人物の電気陰性度を確認していきましょう!





このようになります。そして電気陰性度の差が大きいほど極性は大きくなります。
銀とそれぞれのハロゲンの電気陰性度の差を見ていきましょう
| 電気陰性度の差 | |
| Ag-F | 2.1 |
| Ag-Cl | 1.1 |
| Ag-Br | 0.9 |
| Ag-I | 0.6 |
このようになります。フッ素と銀は電気陰性度の差が大きいため、イオン結合性が高いのです。
しかし、その他を見てみると、電気陰性度の差が小さいので、イオン結晶なのに、共有結合に近い結合になっているのです。
ということでハロゲン化銀はフッ化銀以外は水中で沈殿してしまいます!
また、イオン以外でも極性があれば水に溶けます。水に溶けるかどうかは似た者同士が溶けるので水くらいの電気陰性度が必要なのです。水分子の電気陰性度の差は1.6です。
大体1.6くらい電気陰性度があれば水に溶けます。
フッ化銀だけが溶解することはめっちゃ出るからめっちゃ注意しておいてほしい!
ハロゲン化銀の沈殿の色
普通の教科書ならハロゲン化銀の色とかを説明した後に、ハロゲン化銀の水溶性を話します。
しかし、俺は違います。なぜなら、フッ化銀がそもそも沈殿せえへん理由をちゃんと説明しないと、
なんでフッ化銀が無いんですか?
ってなるから。
ちなみに色に関してはどう頑張っても高校生で理解することは出来ませんので丸暗記です。
ですが、無理やり覚えるのは不可能なので語呂で覚えます。基本的に俺のスタンスは、
↓
②無理な場合は、覚え方を工夫する
なので語呂で記憶にばっちり定着させていきましょう!
AgCl→白色
AgBr→淡黄色
AgI→黄色
これの順番を変えます。
I(ヨウ素)黄色 淡黄色 Br(臭素) Cl 白色
この順番で語呂を作っていきます。
陽(I)気(黄)なのに短気(淡黄)ぶる(Br)のは苦(Cl)し(白)い
と覚えてしまいましょう!
ハロゲン化銀とアンモニア水の反応
次に水よりも溶けやすいアンモニア水とのハロゲン化銀の反応を見ていきましょう!
これは無機化学の沈殿の再溶解のところで出てきます!
もちろん、これも極性が大きい方が再溶解しやすいです。沈殿が生じないフッ化銀は置いておいて、沈殿するAgCl,AgBr,AgIではAgClが一番極性が大きいです。
なので、AgClは過剰なアンモニア水に溶けます。次に極性が大きいAgBrは少しだけ溶けます。最も極性が小さいAgIは溶けません。
『アンモニアも極性が大きい物質』からだよ。
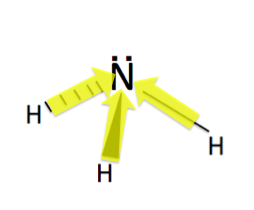
このようにN-Hの結合で極性が生じて、分子全体としても上向きに極性が生じているよね!だから、似た者同士は溶けやすいという性質が発動するんだ!
水だけのときよりも極性物質が多いから少し溶けやすいと理解しておけばいいよ!
ただ、ほとんどAgClしか出ませんけどね!というのも、これは無機の沈殿から陽イオンの分離の問題に出てきます。陰イオン分析もあるにはありますが、陽イオン分析の方がよく出ます。
勘のいい人は既にわかっています(笑)
そう、Cl–なのか?Br–なのか?I–なのか?っていう問題ではなく、
Ag+なのか?Pb2+なのか?Hg+なのか?という問題が出るのです。

ちなみに反応式は書けないとダメです。
AgCl+2NH3→[Ag(NH3)2]++Cl–
という反応が起こります。
まとめ
いかがでしたか?ハロゲン化銀は無理やり暗記っていうイメージがあったと思いますが、電気陰性度で理解できたはずです。(色はせなあかんけど)
このように電気陰性度なんかはホンマに大事です。電気陰性度に関しては何度読んでも足りないことはありません。
それではキッチリ復習をして置いてください!それでは!



















偶然このサイト見つけて引き込まれています。自分じゃ結構勉強しているつもりでしたが。。まだまだ甘いと思い知らされました!
化学結合の解説も読みました。でも,ここみて化学結合混乱しています。(①↓です)
① AgFだけがイオン結合で,AgBrとAgIは電気陰性制度の差が2.0以下なので(イオン結合と共有結合どちらの性質が勝るかという意味で)共有結合とみなしていいのでしょうか? 境界が2.0なら 金属+非金属はイオン結合。非金属同士は共有結合などやらずに,差が2.0以上⇒イオン結合,差が2.0以下⇒共有結合と分類すべきと思いますが?
②↓は知りませんでした。できれば解説をお願いできないでしょうか。この気長に待ちたいです。。
②極性が大きいとなぜアンモニア水にとけるのか説明していただけないでしょうか。一般則として他の沈殿でも使える場合もありますか?無機は暗記すること多いので,少しでも理由や規則がほしいです。
①については、そんなに神経質にならなくてもいいと思います。基本的に共有結合は電気陰性度=E.Nが大きい物同士で非金属同士の反応。イオン結合はE.N が大きい非金属とE.Nが小さい金属が結び付いた反応。金属結合はE.Nが小さい物同士で金属同士の反応。のように教科書通りの分類でいいと思います。無機化学では、理論化学の考え方では説明できない例外的現象なので、なかむらさんの考え方で

現象を理解して、無機化学の反応が頭に入れたらいいと思います。
すばらしい!まさにこれが言いたかった!
②アンモニアの窒素は〔E.Nがフッ素、酸素、窒素の順で高いので〕とてもE.Nが大きい、そして水素はE.Nは窒素ほど大きく無いので共有電子対が窒素に引っ張られて窒素が少しマイナスになって水素が少しプラスに帯電するので極性がある。

だから、このページにもある似た者同士
すなわち、極性のある物は極性のある水溶液に溶けて、無極生の物は無極性の水溶液に溶ける。従って極性のあるハロゲン化銀は水よりも極性のあるアンモニア水にも解けます。
文句無し!
ミナミです.
回答ありがとうございます。
質問してからずっと新研究など色々調べて考えていたので,お礼の返事遅くなりました。
納得するまでずっと考えるタイプなので(^_^;)
① は黄色で強調してもらった文章( ← なかむらコーチありがとう!)でいいんですね。
おかげでスッキリまとまりました。
② も「極性が大きいものは極性溶媒に溶けやすい」という一般即で考えればいいんですね。
質問後,色々と調べて,双極子モーメントまで読みました。
因みに『水よりも極性のあるアンモニア水にも溶けます。』と回答いただいてますが,
極性のあるアンモニア水?
ではなくアンモニアの意味ですよね。
新研究56pによると,水の方が双極子モーメントの値が大きので,
極性もアンモニアよりも水の方が大きいのではないのでしょうか?
そうすると沈殿が水よりもアンモニア水の方にになぜ溶けやすい?
と振り出しにもどってしまいます。
以下,自分の考えの手順(1~4 )をまとめます。
どこかおかしかったら訂正お願いします。
1. アンモニア水の溶媒は水で,アンモニアは最初の溶けだす段階では関係ない。
溶けやすさは溶媒の水で考え,AgCl>AgBr>AgI(極性の順ですよね!)
2. 溶解したわずかの沈殿が溶解平衡の状態になり,Ag+を生じる。
3. Ag+がアンモニアと錯イオンを作り,この反応も平衡状態となる。
4. 3.でAg+が消費されるから,ルシャトリエに原理より,2の平衡はAg+
を生成する溶解の方に進む。
だから水の場合より溶けやすい。
でも,ここで行き詰りました。
2,3の繰り返しで,AgIも平衡の移動で結局溶けてしまわないか?です。
これ以上考えないことにします。
ダラダラ長文読んでいただきありがとうございます。
まあ溶けるかどうかは極性だけじゃないので、
イオンの安定性とかもあります。
[Ag(NH3)2]+
が安定しているからというのも溶解性に関係があります。
①について
なかむら先生の解説であるように、
イオン結合=金属と非金属
共有結合=非金属と非金属は本来の考え方ではありません。もともと、共有結合であるが、結合したもの同士の電気陰性度に大きな違いがあるときはイオン結合になります。今回の場合、本来は電気陰性度が小さい金属Agの電気陰性度が大きく、電気陰性度最強のFのみAgの持つ電子を奪えます。そして相手の電子を奪える時の電気陰性度の差、それが2.0ということです。つまり相手の電子を強い方が奪えばイオン結合に。奪えずどちらも電子を持ったままの場合が共有結合に。電子を奪える時の力の強さは2.0ということです。
②について

先生の解説「似た者同士よく溶ける」の記事に詳しくありますが…。
アンモニアには極性があります。つまり水溶液に+電化のものと−電化のものが存在するのです。この時、同じく極性のあるものを溶かしてやると、液中の+電化を持つものに溶かした物体で−電荷を持つものが。液中で−電化を持つものに溶かした物体の+電化のものが引き寄せられて溶けます。
この考え方から例えば水に塩化ナトリウムは溶けやすいがヨウ素(非極性分子)は水に溶けにくい、などのことが考えられるはずです。
「そうですね!2つとも素晴らしいです!
とはいえ、アンモニア自体は完全に+かーになっているわけでなく、Nはδ-(δとは微少量)Hはδ+に偏っているということにとどめておくべきですね。
完全に+に帯電、ーに帯電となるとイオンの考え方になってしまいます!」
ミナミです。
回答ありがとうございます。参考にします。
電気陰性度差が小さいほど沈殿しやすく、高いほどイオン化して沈殿ができにくいということですね!
まだまだ勉強不足なので、このサイトで勉強させてもらってます。
これからも頑張ってください!
そうです!
はい!がんばってください!
ハロゲン化水素は、原子の大きさが小さいほどイオン状態が不安定だから水にとけにくく、電気陰性度が小さいほどハロゲン化銀の極性が小さく水やアンモニア水に溶けにくい、ということですね。
理解できたので、やっと覚えられそうです!
AgFだけが沈殿を生じない理由がわかって非常に感謝しています。ですが、ハロゲンとカルシウムの塩はフッ化カルシウムのみが沈殿するというのが新たな疑問として湧いて来てしまいました…何故、今度はフッ化物のみが沈殿してしまうのでしょうか?
こちらに解説しました。
https://xn--qck0d2a9as2853cudbqy0lc6cfz4a0e7e.xyz/inorganic/ca-f2
電気陰性度の差が小さいと水に溶けにくいということはわかったのですが、そうするとHClやHBrなどは水に溶けないことになってしまいませんか?混乱しています
プロフィールの画像変えて欲しいです(笑)
なんでやw
AgFが写真フィルムに使われないのは、電気陰性度の関係で結合の安定性が高く、光を当ててもあまり反応しないからですか?
それとも、そもそもAgFが使われない、という私の知識からして間違っているのか、教えていただければ幸いです。
ある問題集でAgFは感光性を示さないとなっていました。
それは電気陰性度の関係でAgFの安定性が高く、光を当ててもあまり反応しないから、という解釈でよろしいのでしょうか。
教えていただければ幸いです。