アルカリ金属の原子は最外殻に1つだけ価電子をもちます。

これがアルカリ金属特有の様々な性質を生みだすのです。
ではくわしく確認していきましょう!
目次
融点が低く、柔らかい軽金属
アルカリ金属はどれも融点が低いです。
ナトリウムは「サウナの温度」で、セシウムにいたっては「東京の夏の気温」で液体になります。
| 種類 | 融点(℃) |
| リチウム | 179 |
| ナトリウム | 97.8 |
| カリウム | 63.5 |
| ルビジウム | 38.9 |
| セシウム | 28.5 |
またどれも柔らかくナイフで簡単に切れます。
これらの性質は原子半径が大きい上に価電子が1つしかないため、金属結合の力が弱いからです。
「遷移元素のクロムとか銅も価電子が1つしかないじゃないか!」
という鋭いツッコミをする人がいるかもしれませんね。
実は遷移元素は、最外殻以外の電子も金属結合に関わっているので金属結合の力が強く、融点が1000℃以上にもなるし超硬いのです!
なぜ最外殻以外の電子も結合に使われるのかについては「d軌道」という概念の理解が必要なので、高校化学では説明ができないのですが…
アルカリ金属とクロムや銅の性質の違いは、典型元素と遷移元素の違いによって引き起こされます。くわしい説明が知りたい人は「「典型元素」と「遷移元素」の違いと見分け方をわかりやすく徹底解説!」を読んでみてください。
1価の陽イオンになりやすい
アルカリ金属は価電子が1つしかなく結合力も弱いので、この電子を容易に手放し、1価の陽イオンになります。
つまりイオン化傾向が強いのです!
メジャーな金属のイオン化傾向を強い順に並べた『貸そうかな、まああてにすんなひどすぎる借金』というリストでも一番初めにカリウムが、3つ目にナトリウムが出てきますね!
K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au
ちなみにリチウムはカリウムよりもイオン化傾向が大きいので、このリストにリチウムを加えるとこうなります。
Li, K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au
このイオン化傾向の完全版ゴロ合わせは、『リーさんに貸そうかな、まああてにすんなひどすぎる借金』
と覚えましょう!
借金まみれのリーさんに、お金を貸してと頼まれたから貸そうかと思うけど、お金が返ってくるのはあてにしないという状況をイメージしてください!
非常に反応性が高い
アルカリ金属は水や空気と反応しやすいため、実験室で保管する際は「石油の中で保管」します。
この性質も、「電子を失いやすい」ことに関係しています。
電子を失いやすいということは「酸化されやすい」ということです。
したがって空気中の酸素によってすみやかに酸化され、酸化物になります。
ナトリウムなどのアルカリ金属をナイフで切ると、切った断面は少しの間だけ金属光沢を示します。
しかし、すぐに表面が酸化して曇ってしまうのです。
4Na + O2 → 2Na2O
また酸化されやすい=還元力が強いので、水と接触すると激しく還元反応を起こして水素を生じます。
残った水溶液にはアルカリ金属の水酸化物が溶けているので、強アルカリ性を示します。これが「アルカリ金属」の名前の由来なんです!
2Na + 2H2O → 2NaOH + H2↑
このようにすぐに他の物質として反応して化合物になってしまうので、私たちの身の回りでアルカリの金属の単体を目にすることがほとんどないのですね!
特有の炎色反応を示す
アルカリ金属やアルカリ土類金属の価電子は、熱エネルギーを与えられると1つ上の電子軌道にジャンプします。

しかし本来位置するべき軌道にいないと安定しないので、すぐ元の軌道に戻ります。
その時、持っていた余分なエネルギーを電磁波=光として放つのです。

これが「炎色反応」です。
このときの色は元素によって決まっているので、炎色反応は元素の特定に用いることができます。

アルカリ金属の炎色反応の色は
リアカー無きK村
(Li赤、Na黄、K紫)
と覚えましょう!
単体は「融解塩電解」で精製する
アルカリ金属はイオン化傾向が強く反応性も大きいので、単体を取り出すのが難しいです。
例えば食塩水(NaCl水溶液)を電気分解してナトリウム(Na)の単体を精製しようとしても、陰極からは水素(H2)が発生してしまいます。

ナトリウム(Na)は水素(H)よりイオン化傾向が大きいからです。
しかしもしそこに「水素(H)」が無かったら…?
ナトリウムが取り出せるはずですよね!?
つまり水素の発生源である水(H2O)を加えず、加熱して融解させた塩化ナトリウム(NaCl)を電気分解するのです!
こうすれば、陰極からナトリウムの単体(Na)が取り出せます。
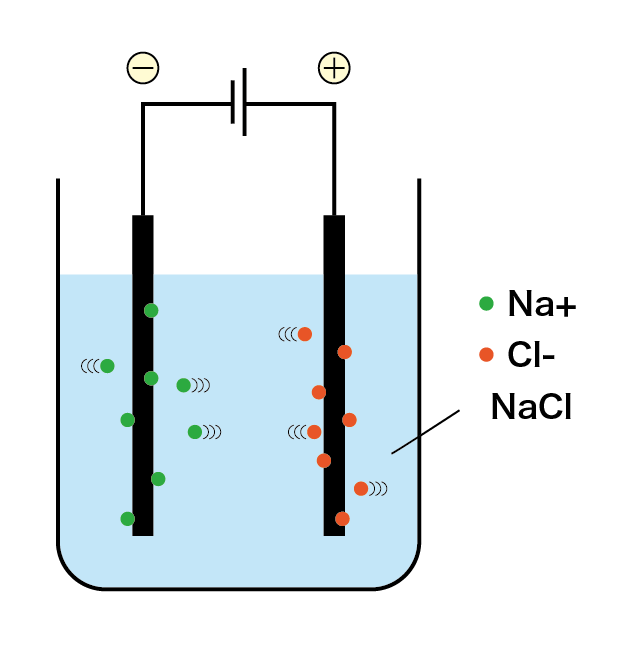
これが融解塩電解という方法です。
融解塩電解と、この方法によって精製されるナトリウム単体についてのより詳しい解説はこちらの記事をご覧ください。
まとめ
この記事ではアルカリ金属の性質を徹底解説しました。
<アルカリ金属の性質>
- 融点が低く、柔らかい軽金属
- 1価の陽イオンになりやすい
- 非常に反応性が高い
- 特有の炎色反応を示す → リアカー無きK村
- 単体は「融解塩電解」で精製する
です!
アルカリ金属そのものがアルカリ性なのではなく、単体が水と反応してできる水溶液がアルカリ性だということがポイントですよ!