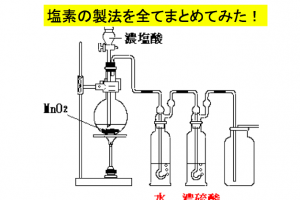
バイヤー法はアルミニウム精製に不可欠ですが、アルミニウムそのものを作るのではなく原材料の処理に用いる反応です。
この反応にはアルミニウムの「両性元素」という性質が深く関わっています。
この記事ではこのアルミニウムの性質に基づき、バイヤー法を徹底的にわかりやすく解説します!
ホール・エルー法について詳しく知りたい人は、この記事を読んで見てください。
目次
バイヤー法とは

バイヤー法とは、不純物を多く含んだ原料鉱石のボーキサイトから純粋な酸化アルミニウムであるアルミナを取り出す方法。
天然で産出するアルミニウムの原料は、酸化アルミニウム(Al2O3)・酸化鉄(Fe2O3)・二酸化ケイ素(SiO2)の混合物であるボーキサイトです。
ここから純粋なアルミニウムを作り出すためには、まず不純物である酸化鉄と二酸化ケイ素を分離し、酸化アルミニウムだけを取り出す必要があります。
そのために使われるのがアルミニウムの「両性元素」という性質です!
アルミニウムは両性元素

イオン化傾向が水素より小さい金属は酸と反応し、水素を発生しながら溶けます。
しかし通常、金属は塩基とは反応しません。
ところが典型金属のアルミニウム・亜鉛・スズ・鉛の4元素は酸だけでなく強塩基にも反応し、錯イオンを生成して溶けるのです。
このような元素を両性元素と呼びます。
つまりポイントはアルミニウムは両性元素なので酸にも強塩基にも溶けるということです!
ちなみに両性元素4種には下のような有名な語呂合わせがありますので、この機会に覚えてしまいましょう。
体表がヌルヌルしているカエルなどの「両性」類は、いろんなところに「すんなり」入れるというイメージです。
両性元素が酸にも塩基にも反応する理由

でもなぜ両性元素は酸にも塩基にも反応するのでしょう?
その秘密は、これらの元素が金属の中でも比較的非金属に近い性質をもつということ。
上の周期表を見ても分かる通り、両性元素は非金属元素の近くに位置していますよね?
普通の金属は電子を手放して陽イオンになろうとするのですが、両性元素は非金属に近いのでその性質がそこまで強くありません。
それどころか強塩基環境下では、水酸化物イオンと電子を共有して錯体をつくり陰イオンとなることで溶けるのです。
2Al + 2NaOH + 6H2O → 2Na+ + 2[Al(OH)4]– + 3H2↑
ちなみに[Al(OH)4]–には、「テトラヒドロキシドアルミン酸イオン」という呪文のような名前がついています。
バイヤー法の流れ
① ボーキサイトを水酸化ナトリウム溶液に溶かす

酸化アルミニウム(Al2O3)・酸化鉄(Fe2O3)・二酸化ケイ素(SiO2)の混合物であるボーキサイトに、強塩基である濃水酸化ナトリウム(NaOH)水溶液を加え加熱すると、両性元素である酸化アルミニウムだけが溶けます。
Al2O3 + 2NaOH + 3H2O → 2Na+ + 2[Al(OH)4]–
② ろ過し、不純物=赤泥を取り除く

この溶液をろ過すると、溶けなかった酸化鉄(Fe2O3)と二酸化ケイ素(SiO2)を取り除くことができます。この不純物は酸化鉄の赤い色から「赤泥」と呼ばれます。
③ 塩基性を弱め、水酸化アルミニウムを沈殿させる

ろ液を水で希釈すると塩基性が弱まるので水に溶けきれなくなり、水酸化アルミニウム(Al(OH)3)として沈殿します。
2Na+ + 2[Al(OH)4]– → Al(OH)3↓ + Na+ + OH–
④ 水酸化アルミニウムを熱し、アルミナ(酸化アルミニウム)にする

生じた水酸化アルミニウム(Al(OH)3)を1200℃まで加熱すると、脱水して酸化アルミニウムが生じます。
2Al(OH)3 → Al2O3 + 3H2O
バイヤー法の歴史

バイヤー法の発明者は、ドイツ人科学者のカール・ヨーゼフ・バイヤー氏。
19世紀後半当時、アルミニウム単体を金属として利用することはまだ行われていませんでした。
彼の目的は、染色の媒染剤として用いる純粋な酸化アルミニウム=アルミナを、ボーキサイトから取り出すこと。
しかし同時期に発明された酸化アルミニウムから融解塩電解によってアルミニウム単体を取り出す「ホール・エルー法」の前処理段階として、バイヤー法は必須だったのです。
やがて工業におけるアルミニウムの重要性が増し、バイヤー法は化学の世界における超重要反応となりました。
現在でもアルミニウムの生成に不可欠な反応として、世界中で行われています。
まとめ
バイヤー法とは何か、理解できましたか?
- バイヤー法は、不純物を含むボーキサイトからアルミナ=酸化アルミニウムを取り出す反応。
- アルミニウムは両性元素なので強塩基に溶ける。
- ボーキサイトを水酸化ナトリウム溶液で処理し、溶け出したアルミニウムを不純物から分離する。
- 加水し塩基性を弱めると、水酸化アルミニウムが沈殿する。
- 水酸化アルミニウムを加熱脱水して、酸化アルミニウムを取り出す。