こんにちは。


日常生活でよく聞く「カルシウム」という言葉。ほとんどの場合、それは骨や歯の主成分である「リン酸カルシウム」のことです。
一方カルシウムそのもの、つまり「カルシウム単体」がどのような物質かはあまり知られていません。
この記事では、カルシウム単体の性質と反応を徹底解説します!
目次
カルシウム単体の性質
まずはカルシウム「単体」とはどのような物質か、確認していきましょう!
カルシウム単体の基本的な性質

これが単体の「カルシウム」です!
一般的なカルシウムのイメージとはかなり違いますね。
カルシウムは、原子番号20のアルカリ土類金属です。
金属なので、上の写真のように金属光沢を持ちます。
元素記号はCa。原子量は40。融点は839℃。密度は1.55g/cm3。
イオン化エネルギーは590kJ/molで、イオン化傾向の大きい金属です。
アルカリ土類金属の共通性質

アルカリ土類金属とは、2族元素の第4周期以降の元素「カルシウム(Ca)・ストロンチウム(Sr)・バリウム(Ba)・ラジウム(Ra)」の総称です。
共通の性質は銀白色で柔らかい軽金属で反応性も高く、水と反応して水素を発生すること。
しかし1族のアルカリ金属より自由電子の数が多いため金属結合が強くなり、1族より密度・融点・硬さが大きくなり反応性は低くなります。
しかし遷移元素の金属と比べると、はるかに反応性は高いです。
アルカリ土類金属もアルカリ金属と同じく炎色反応を示すのが特徴で、カルシウムは上の写真のように橙赤色(とうせきしょく)を示します。
アルカリ金属や遷移元素について詳しく知りたい人は、こちらの記事も読んでみてください。
カルシウム単体の反応
受験に頻出のカルシウム単体の反応には、下のようなものがあります。
カルシウム単体と酸素との反応
カルシウム単体を空気中で加熱すると、炎をあげて下のように反応します。
2Ca + 2O2 → 2CaO
生じる酸化カルシウム(CaO)は、生石灰として知られている物質です。
カルシウム単体と水との反応
カルシウム単体は水と下のように反応し、水素を生じます。
Ca + 2H2O → Ca(OH)2 + H2
この時生じる水酸化カルシウム(Ca(OH)2)は水に可溶で、水溶液は強塩基性を示します。
カルシウム単体と塩素との反応
カルシウム単体は塩素ガスと激しく反応し、塩化カルシウム(CaCl2)を生じます。
Ca + Cl2 → CaCl2
ナトリウムとの比較
ここまで読んで「カルシウムの性質って、ナトリウムの性質と似てるな〜」と思った人もいるかも知れません。
実はアルカリ土類金属であるカルシウムの性質は、アルカリ金属のナトリウムの性質と結構似ています。
しかし性質の「強さ」は、ナトリウムより弱いのです。
ドラゴンボールに例えるならばカルシウムがナッパで、ナトリウムがベジータ。
香辛料に例えるならばカルシウムが一味唐辛子で、ナトリウムがハバネロ。
という感じです!
比較を下の表にまとめてみました。
| カルシウム(Ca) | ナトリウム(Na) | |
| 密度 | 1.55g/cm3 | 0.97g/cm3 |
| 融点 | 839℃ | 98℃ |
| イオン化エネルギー | 590kJ/mol | 496kJ/mol |
| 水との反応 | 反応して水素を発生 | 激しく反応して水素を発生 |
| 炎色反応 | あり・橙赤色 | あり・黄色 |
| 保存方法 | 不活性ガス中に保存 | 石油中に保存 |
基本的な性質は似ていますが、カルシウムはナトリウムよりも密度が大きく反応性が穏やかです。
また融点はかなり高くなっています。
この性質の違いは一体なぜ生じるのでしょうか?
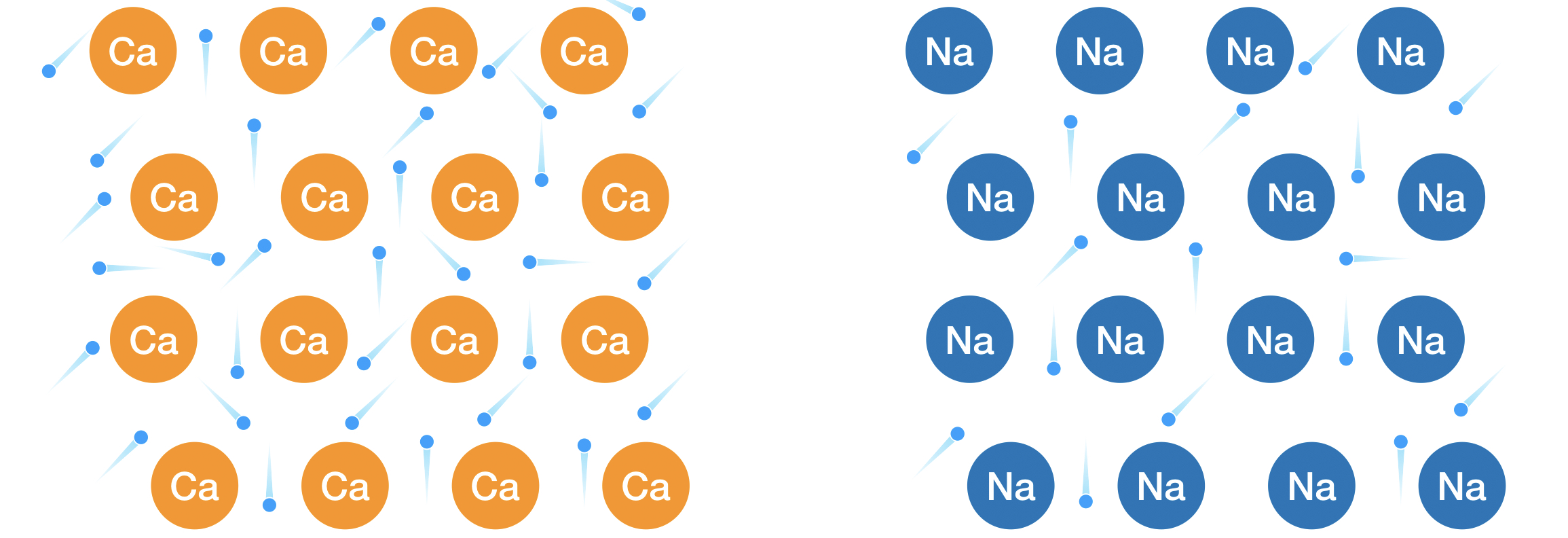
ナトリウム原子は、最外殻に価電子を1つだけ持ちます。
一方カルシウムは2つあるため、より多くの電子が自由電子として原子間を移動します。
その結果金属結合が強くなり、反応性が弱まり融点が上がるのです。
ナトリウム単体の性質や製法について詳しく知りたい人は、この記事を読んでみてください。
まとめ
カルシウム単体には以下のような性質があります。
- 白銀色の柔らかい軽金属
- 水と反応して水素を発生させる
- 反応性が高いため不活性ガス中に保存する
- 橙赤色の炎色反応を示す
またカルシウム単体の主な化学反応には、次のようなものがあります。
- 2Ca + 2O2 → 2CaO
- Ca + 2H2O → Ca(OH)2 + H2
- Ca + Cl2 → CaCl2
日常生活で目にする「カルシウム」(実はリン酸カルシウムなどのカルシウム化合物)とは大分性質が違うので、注意しましょう!