こんにちは。


気体の乾燥剤として受験に頻出の塩化カルシウム。その性質はなぜか教科書や参考書ではあまり詳しく取り上げられません。
しかしこの重要物質の性質を理解しないと、気体の乾燥やそれを活用した元素分析に関わる問題を論理的に解くことはできないのです。
この記事では塩化カルシウムの性質や使い方を分かりやすく徹底解説します!
目次
塩化カルシウムの性質

まずは塩化カルシウムとはどのような物質かを見ていきましょう!
塩化カルシウム(CaCl2)は、常温では上の写真のような白色の固体です。
式量は111。密度は2.15g/cm3。
水への溶解度が大きいのが特徴で20℃で100mLの水に74.5gも溶け、さらに多量の溶解熱(285J/g)を生じます。
溶解度が大きいため凝固点降下の作用も大きく、30%の水溶液の凝固点はなんと−55℃まで下がります。
- 溶解度が大きい
- 水に溶けると多量の溶解熱を生じる
- 凝固点降下の作用が大きい
塩化カルシウムの用法
続いて塩化カルシウムが何に使われているのかを見ていきましょう!
除湿剤・乾燥剤

塩化カルシウムのように水に非常に溶けやすい物質は、空気中の水分さえも吸収しその中に溶け込もうとする「潮解性」があります。
そのため塩化カルシウムを水分を含んだ空気中においておくとその中の水分を吸収し、空気を乾燥させるのです。
この性質を利用し、塩化カルシウムは日常生活では上の写真のような湿気とりとして、化学の世界では「気体の乾燥剤」として用いられるのです。
潮解についての解説はこの「水酸化ナトリウム」についての記事内でしていますので、詳しく知りたい人は読んでみてください。
この「乾燥剤」というのが、受験化学に頻出の塩化カルシウムの用法です。
塩化カルシウムが乾燥剤として重宝されるのは強酸と強塩基の塩=中性のため、酸性の気体も塩基性の気体も乾燥させることができるから。
ただし下のように反応してしまうため、アンモニアの乾燥には用いることができません。
CaCl2 + 8NH3 → CaCl2・8NH3

有機化学の超重要項目「有機化合物の構造決定」における元素分析の場面で、塩化カルシウムはよく使われます。
上の図のような「炭素(C)・水素(H)・酸素(O)だけからなる有機化合物」を燃焼させると、生じるのは二酸化炭素(CO2)と水(H2O)だけですよね?
この二酸化炭素と水の質量を測定すれば、元の化合物にどれだけの炭素(C)・水素(H)・酸素(O)が含まれていたのかが分かり組成式が求められるのです!
ではどうやって発生させた二酸化炭素と水の質量を測るのか? ここで登場するのが「ソーダ石灰」と「塩化カルシウム」です。
ソーダ石灰は酸化カルシウム(CaO)の小粒の表面に水酸化ナトリウム(NaOH)をコーティングしたもの。塩基性化合物なので、水に加え酸性の二酸化炭素も吸収します。
一方、塩化カルシウムは上で確認したように中性化合物なので水しか吸収しません。
これを下の様に配置することで、水と二酸化炭素を分離して吸収させることができるのです。

この「塩化カルシウム→ソーダ石灰」という順番がポイントです!
もし配置が逆だと水も二酸化炭素もソーダ石灰に吸収されてしまい、分析が出来なくなってしまうのです。
元素分析のより詳しい方法や実際の問題演習については、こちらの記事で詳しく解説していますのでぜひ読んでみてください。
また塩化カルシウムと共に元素分析に使われる「ソーダ石灰」について、より詳しく知りたい人はこちらの記事をどうぞ!
融雪剤・凍結防止剤

塩化カルシウムは冬季に道路や駐車場に撒く融雪剤・凍結防止剤として利用されています。
雪の多い地域では冬になると道路のそばに置かれていたり、ホームセンターで販売されたりしていますね。
凝固点が大きく下がるということは、0℃以下まで温度を下げても凍らないということ。
さらに高い融解熱を持つため、固体の塩化カルシウムを氷や雪の上に撒くと発熱して溶かすのです。
塩化カルシウムの製法
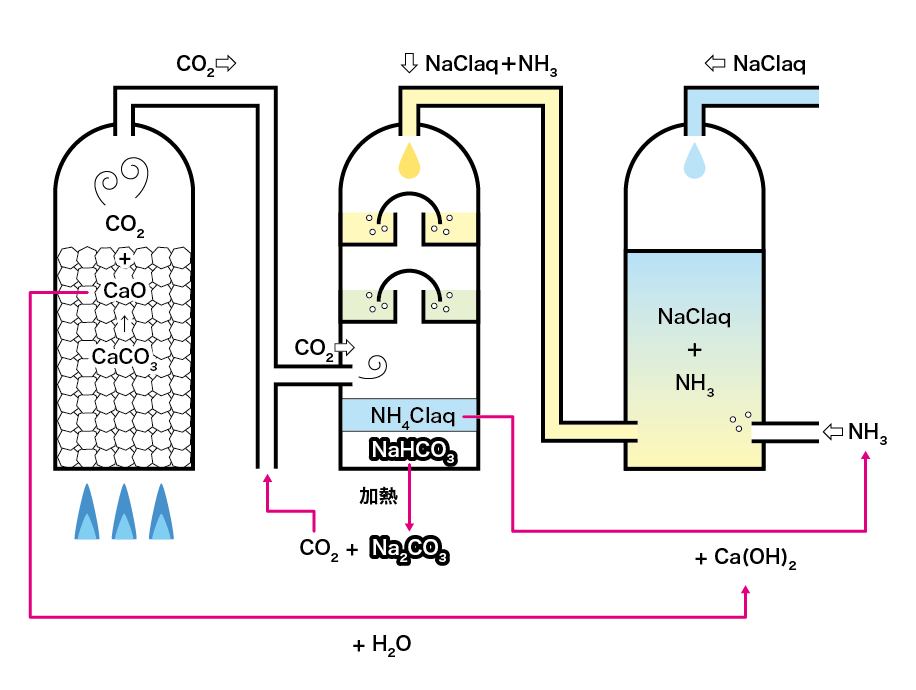
工業的には、炭酸ナトリウムを精製する「ソルベー法」の副産物として得られます。
塩化アンモニウム水溶液(NH4Cl)と水酸化カルシウム(Ca(OH)2)を反応させると、弱塩基遊離反応によって、アンモニア(NH3)と塩化カルシウム(CaCl2)が生じるのです。
2NH4Cl + Ca(OH)2 → 2NH3 + 2H2O + CaCl2
また水酸化カルシウム(Ca(OH)2)を塩酸(HCl)で中和することによっても、得ることができます。
Ca(OH)2 + 2HCl → 2H2O + CaCl2
ソルベー法は高校化学に出てくる数多くの「工業的製法」の中でも、特に重要なものです。
より詳しく知りたい人はこの記事も読んでみてください!
まとめ
この記事では、塩化カルシウムの性質・用法・製法について解説しました。
- 溶解度が大きい
- 水に溶けると多量の溶解熱を生じる
- 凝固点降下の作用が大きい
- 融雪剤・凍結防止剤
- 除湿剤・乾燥剤
★ 元素分析の乾燥剤として用いるときは、塩化カルシウム→ソーダ石灰の順で用いる!
- ソルベー法の副産物
- 水酸化カルシウムを塩酸で中和