どうも、受験化学コーチなかむらです。


濃度98%の硫酸(H2SO4)である「濃硫酸」は、強い吸湿性を持つので乾燥剤として用いられます。
しかし、当然ながら濃硫酸と反応してしまう物質の乾燥には用いることができません。
この記事では濃硫酸による乾燥の仕組みから、濃硫酸を乾燥剤として使えない物質とその理由を詳しく解説しています。
目次
濃硫酸が乾燥剤として使われる原理

硫酸(H2SO4)の分子は上のような構造。
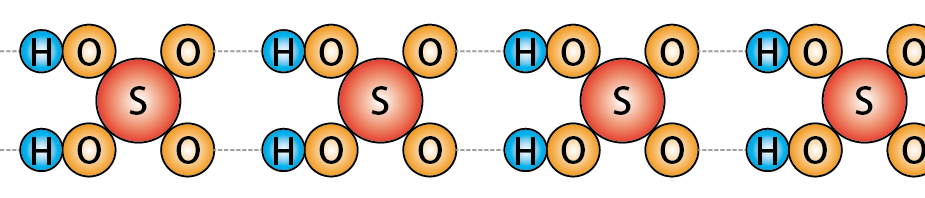
分子同士が次々と水素結合によって会合するため、濃硫酸は高い粘性を持っています。
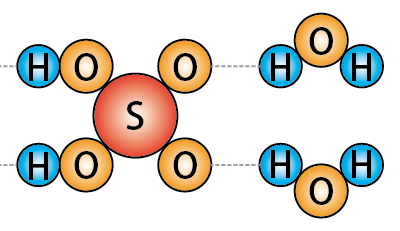
また硫酸分子は上の図のように水分子とも水素結合を形成するため、吸湿性を持つのです。
濃硫酸を乾燥剤として使うときの装置
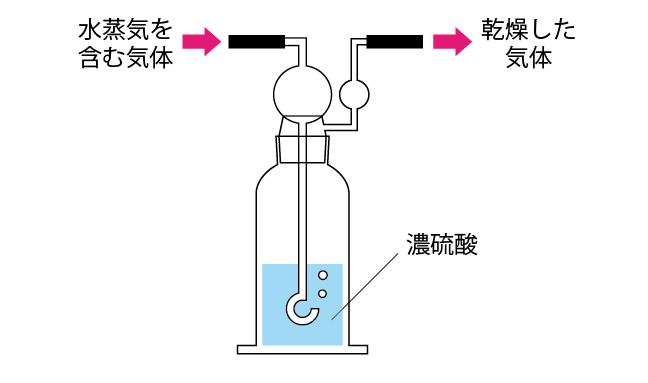
固体の乾燥剤の時は「U字管」や「乾燥塔」という器具を使うのですが、濃硫酸は液体なので上のような「洗気びん」を用います。
洗気びん上部に球体がついているのは、逆流防止のため。
濃硫酸がこぼれたら大変ですもんね。
また安全のため、濃硫酸の液量は容積の1/2以下にします。
濃硫酸を乾燥剤として使えない物質
優秀な乾燥剤である濃硫酸ですが、乾燥するには不適当な物質もあります。
塩基性の気体
アンモニアなどの塩基性気体は濃硫酸と中和反応をおこすため、乾燥することはできません。
2NH3 + 2H2O + H2SO4 → 2(NH4)OH + H2SO4 → (NH4)2SO4 + 2H2O
硫化水素(H2S)
濃硫酸を熱した「熱濃硫酸」は酸化作用を示します。
しかし還元剤である硫化水素(H2S)とは、常温でも酸化還元反応をおこすため乾燥することができません。
H2SO4 + H2S → S + SO2 + 2H2O
なぜ熱濃硫酸が酸化作用を持つのかについては、こちらの記事を読んで見てください!
不飽和炭化水素
濃硫酸は触媒として作用し、エチレン(C2H4)やアセチレン(C2H2)のような不飽和炭化水素に水素を付加させエタノールにしてしまうため、乾燥に用いることはできません。
CH2CH2 + H2SO4 → CH3CH2OSO3H
CH3CH2OSO3H + H2O → CH3CH2OH + H2SO4
まとめ
- 濃硫酸は水分子と水素結合を形成するため、強い吸湿性をもつ。
- 濃硫酸を乾燥剤として用いる際は、「洗気びん」を用いる。
- 濃硫酸は中性または酸性の気体の乾燥に用いることができる。
- 濃硫酸を乾燥剤として用いることが出来ないのは、
- アンモニアなどの塩基性の気体
- 硫化水素
- エチレン・アセチレンのような不飽和炭化水素
- 一酸化窒素