こんにちは。
入試で非常に重要なハロゲン、その中の水素との化合物であるハロゲン化水素についてまとめてみます。
ハロゲン化銀についてはこちらでまとめました
今回の記事も死ぬほど電気陰性度が重要になるので、電気陰性度を知らない人はちゃんと理解しておいてくださいね!
この記事ではハロゲン化水素に関して全部書きました(多分)なのでハロゲン化水素のことならこれを見ましょう!
目次
ハロゲン化水素とは
ハロゲン化水素とは、ハロゲン原子と水素原子が共有結合した分子のことです。

ハロゲンは電気陰性度が大きいので、ハロゲンをXとしたら、ハロゲン化水素は、下図のように

極性分子であるといえます。
ってことは、ハロゲン化水素は水に溶けるってことですよね!


H+投げそう!!!
ま、まあね(笑)そ、そだねたしかにH+投げそうだね、、、だからハロゲン化水素は酸性物質なんだ。
ハロゲン化水素でよく問われるところ
ハロゲン化水素の性質としてよく問われるところが2つあります。
それは、
①ハロゲン化水素の酸の強さの順番
②なんでフッ化水素だけ弱酸である理由
です。
この2つがよく問われるのは受験生が勘違いしやすいからなんです。だから、ここらでキッチリ学んできましょう!
①ハロゲン化水素の酸の強さの順番
ハロゲン化水素の酸性の強さは、
HF<HCl<HBr<HI
と、周期表の下に行く方が酸性が強くなるんです。
てことは、上のやつのほうが水素から電子を奪いやすくて、H+をどんどん投げて強酸になりそうなのに、、、、
そう、良い考え方だ!そう、たしかにその考え方はすごいわかる。
その考え方だけでいくと、HF>HCl>HBr>HIだろうね!
そう、実は別の原因でこの順番が逆になっているんだ。まずは考えてほしいのは強い酸性であるというのは、
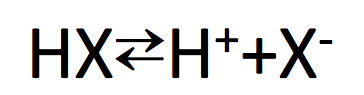
なるべく電離して、HXのうち多くが、右辺のH++X–になっていれば酸性が強いと言える。
たしかに、右辺への行きやすさ。つまりは、H-Xの結合の切れやすさは、たしかにHF>HCl>HBr>HIです。
しかし!!!!!!
切れたところで右辺がメチャクチャ不安定だったらどうでしょう?
化学物質はなるべく安定な方向へ移動したいものなのです。この安定な状態というのは、平衡状態といいます。
俺は平衡状態を自分の部屋で例えて、世界一わかりやすく説明できます。平衡状態って実際どんな状態なの?って思っている人はコチラの記事!
つまり漫画のように考えるとこういうことや!
ステップ①まず結合切ってみる

ステップ②不安定やった分戻ってみる
というわけです!
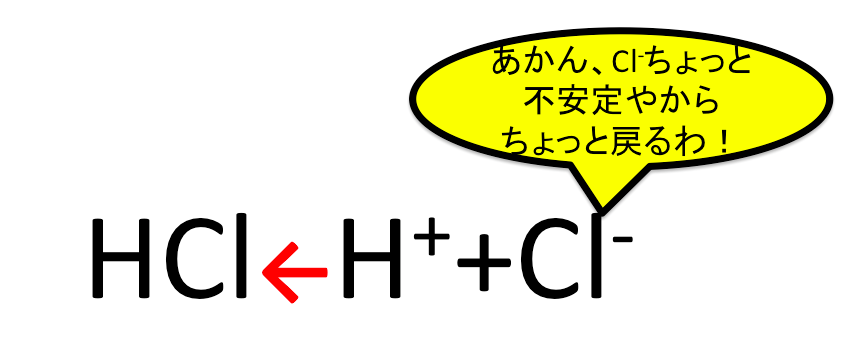
つまりですよ、電離する力的には、HF>HCl>HBr>HIだったとして、陰イオンが安定していないことには、平衡状態にならずに戻ってしまうのです。
その陰イオンの安定性が、F–<Cl–<Br–<I–なのです。これにより、Cl–とかは残念ながら、すこし不安定なんです。だから左辺に戻ってしまうんです。
そして、このような陰イオンの安定性に関してですが、

この陰イオンのイオン半径ですが、原子番号が大きくなればなるほど安定していきます。
これどういうことかというと、電子の影響が大きいと不安定になるのです。電子をこの粒だとします。

すると、

ハロゲンに1つの電子がつくとこのようになります。
この電子の影響を受けやすさはイオン半径によります。I-はイオン半径が大きいために、この電子の影響を受けにくいですが、F-はイオン半径が小さいのでかなり影響を受けてしまいます。
するとF–は不安定になってしまいます。
不安定だから、
HF⇄H++F–から左向きに反応が戻ってしまいます。
この戻りが一番少ないのがI–なので、最も酸性度が強いのです!
注意①ちなみに、間違ってほしくないのは、HClもHBrもHIも強酸であることには違いありません。その中での話をしているわけで、
「じゃあHClは弱酸じゃないんですか?」とかそういうコメントは無しです。
注意②強酸って100%電離じゃないんですか?と言うかもしれませんが、それは高校化学での強酸の扱いです。本当は強酸の中でも電離定数はことなります。受験の問題を解く上では、基本的にHClもHBrもHIも電離度100%だと思って大丈夫です。
強酸の中でも電離定数の差があることを利用したものに、『揮発性酸遊離反応』というものがあります。読んでみてね!
②HFだけ弱酸である理由
フッ化水素だけなぜか弱酸なのです。0.1mol/Lの時のハロゲン化水素の電離度をまとめてものが下の表
| HX | HF | HCl | HBr | HI |
| 電離度 | 0.10 | 0.926 | 0.935 | 0.95 |
(出典:新研究p342)
HFの電離度だけレベルが違う小ささなんです。HCl,HBr,HIは高校化学では強酸で扱います。しかし、HFだけ弱酸なんです。
これは、いくらなんでもおかしいんとちゃいますか? って思いますよね。実は、この理由はFの電気陰性度が大きくて、分子同士が水素結合するからなんですよ!

このように、HF同士が結合してしまうわけです。本来投げられるはずのHが他のFと結合してしまうと、H+だけ投げることが難しくなるのです。
H+が飛び出るのが抑制されているわけですからね。これによって、フッ化水素は弱酸なのです!
テストではこうやって書いたらええで!

ハロゲン化水素の沸点
基本的に沸点は、分子量が大きいほど大きくなります。
それに関しては、ファンデルワールス力のところで説明しています!
ということは、ハロゲン化水素で言うと、沸点が高いのは、HI>HBr>HCl>HFになるはずですよね!
じゃあ1個ずつ沸点を見ていきましょう!
HIは-35℃
HBrは-67℃
お、HBrの方が沸点が低い!
HClは-85℃
めっちゃ順調ですよね!!!
HFは20℃
なんでやね〜〜〜〜ん!!!
あなたもこう叫んだことだろう。そう、フッ化水素だけ突如法則を完全に無視してくるんです。
ほかの3つとは違う動きをHFだけするのです。それが、水素結合です。

HF分子同士が水素結合し、『HFHFHFHF』が1つの分子見たいになっちゃうんです。こうなると、見かけの分子量がどんどんデカくなる。
→ファンデルワールス力もデカくなる
→沸点も高くなる!
というわけなんです!
よってハロゲン化水素の沸点はこういう摩訶不思議なグラフになってしまうのです。

フッ化水素
ハロゲン化水素の中で特殊な生態を示すこいつについてまとめていこうと思います!
フッ化水素の製法
フッ化水素は、ホタル石(CaF2)と濃硫酸を混ぜて加熱することで取り出すことが出来ます!
この反応は揮発性酸遊離反応と言われています。
このフッ化水素の製法は詳しくはこちらの記事に書いていますので、全力で読んでください!
フッ化水素を下方置換で捕集する理由
フッ化水素というのは、分子量で言うと、20です。
空気の平均分子量28.8よりも小さく、水に溶けやすいのでため本来は上方置換であるはずです。
なのに、なぜかフッ化水素は『下方置換』なんです。それは、

フッ化水素が水素結合をして、二量体になっているからです。このように2個1みたいな感じになっているので、見かけの分子量が40あるんです!
てことは、当然上方置換では集められませんよね!だから下方置換で集めます!
ガラスの腐食反応〜SiO2のエッチング〜
SiO2はガラスの原料です。そして、そのガラスを腐食する反応としてHFが使われます。
SiO2はそこら中にある石ころの原料です。そこら中の石ころが何か激しい反応をしているところを見たことがありますか?
つまり、この反応はかなり異常な反応であり、あなたにももっと感動してほしいんや!
だってやで、SiO2のSiって言うのは、普通なら最上級に酸化された状態じゃないですか。だって、普通酸素の酸化力に勝てる奴なんていないからです。
だから、まさかSiはO以上の奴が自分の電子を奪いに来るとは思っていないんですよ。ですが、思い出してください。電気陰性度は、 F>O>Nでしたね。つまり、たった1つの元素だけSiO2のSiをより酸化することができる奴がいるんです。
それが全原子最強の電気陰性度Fなのです。日常生活で最強に酸化が完了した状態は酸化物です。しかし、今回史上最強に酸化が完了した状態「フッ化物」になるのです。
今までみんなOが出て来たら終わりだ、、Oだもんな仕方ないもんな、、、ってSiO2のSiの電子をOから奪い取ろうなんて奴はいませんでした。

そして、今後電気電子や半導体レーザーとかそういう分野にすすんでいきたいな〜なんて思っている人は、この反応が非常に重要になってくる。
このSiO2をHFaqまたは、HF(g)で削るこの反応を『エッチング』って言うんやで!そして、フッ化水素酸(フッ化水素水溶液)でSiO2を削ることをウェットエッチングと言って、
気体のHFで削ることをドライエッチングと言います!
多くの人が、このフッ化水素による腐食反応を意味もわからず覚えているから、ごちゃごちゃになって、
あれ、なんでH2SiF6になるものと、SiF4になるものがあるの?まあいいや、意味わからないけど覚えちゃえ!
とやってしまうのです。全部ちゃんと理解して身につけることが出来るのに、、、この積み重ねが無機嫌いの原因です。
無機はちゃんと理解したらおもろいんで、ちゃんと理解していきましょう!
ドライエッチングとその反応式の書き方
ドライって言うのは、乾燥のこと、つまり、水あらへんで!ってことです。
SiO2を水が無い状態でHFでエッチングしていきます。そのためにはまずSiO2がどんなもんか確認していきましょう。
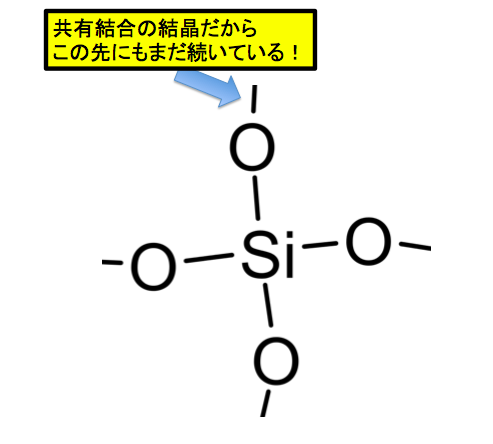
1つのSiに着目するとSiO2はこのようになります。よくある勘違いでSiO2が分子だと思っている人が居ます。
しかし、SiO2は分子ではなく、共有結合の結晶であり、SiO2というのは組成式です。このSi-Oの結合をぶった切って、Fに取って代わってしまうのがこのドライエッチングです。
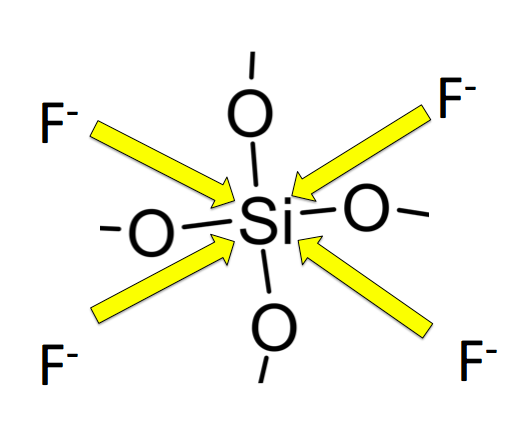
このように四方からSiにアタックをしていきます!これによって、Oが全てFに変わりますので、SiF4になります!

このような反応なので、ドライエッチングに関しては対して反応式を書くことは難しくないんですよ!
SiO2+4HF→SiF4+2H2O
という反応になります。
ウェットエッチングとその反応式の書き方
ウェットエッチングですが、
まず、SiO2とHFaqの反応式ですが、酸化物+水溶液の反応のときは、反応式を二段階に分けなければなりません!
このフッ化水素酸を使ったガラスの腐食反応であるウェットエッチングの反応式は原理通りです。
SiO2という酸化物と水溶液の反応はまず水と反応させた後に、HFと反応させれば良いのです!
ステップ①まずSiO2と水を反応させる
SiO2+H2O→H2SiO3
のようにまず水酸化物にしていきます。
ステップ②H2SiO3とHFを反応させる
H2SiO3+6HF→H2SiF6+3H2O
となります。
この出来たH2SiF6は『ヘキサフルオロケイ酸』と言います。
このように、エッチングのすごいところは、完全無敵とも思われた「SiO2」と言うカチコチの共有結合の結晶を、化学的に酸化還元反応をして分子に変化させることで、削り取ることができるようになったのです。
塩化水素
塩化水素は最も入試で出題されるハロゲン化水素です。なのでここでも全てを上げきれている自信がありませんが、様々なところで塩化水素が絡む場面を上げてみました。
塩化水素の製法
HClの製法は非常に大学受験で出題されやすいです。これは反応式も聞かれますし、どのようなプロセエスで発生するかと言うところまで聞かれます。
HClは沸点がかなり低いです。さきほどもやりましたよね!これにより
アンモニアの検出としても使われるHCl
アンモニアの製法で、発生した気体がアンモニアであることを確認するために、HClを使うことがあります。
アンモニアに塩酸を加えると、
NH3+HCl→NH4Clとなり、このNH4Clが白色のイオン結晶になって、白煙となります!
もっと詳しく知りたい方はこちらのアンモニアの製法の記事にまとめてあります!
最後に
ハロゲン化水素は非常に入試に出やすいですし、いろんな反応もあります。
全部理屈無しに丸暗記したら、本当に無機化学が嫌いになってしまいます。だから理屈。電気陰性度など今までに知っている知識をフル活用して理解して覚えましょう!






















フッ化水素が水に溶けるときは激しく反応しないのにフッ素が水に溶ける(2F2+2H2O→4HF+O2)の時は激しく反応するのは何故ですか?
また他のハロゲンとハロゲン化水素に関してはどうなりますか?
酸化還元反応かどうかです
なかむらさんの記事のお陰で、嫌いかつ苦手だった化学がわかるようになって勉強も楽しくなりました!本当にありがとうございます
一つ質問があります。
ウェットエッチングで、フッ素が最強の還元剤になるとのことでしたが、もともとフッ化水素酸のフッ素もイオンではないのですか?
酸化還元反応で、電子の授受は行われていますか?
書き方が悪かったので直しましたが、
フッ素は相手を酸化しますので、酸化剤です。
SiがFにより電子を引っ張られるようになりました。
酸化剤でした、ごめんなさい。
ありがとうございます!
ウェットエッチングでまずガラスを水と反応させて、その後フッ化水素酸と反応させるところですが、6HF+H2SiO3→H2SiF6+3H2Oの立式がイマイチ自分で作ることができないです。何かわかっていないのでしょうか。
ケイ素は非金属だから酸性酸化物のはずで、水に溶かした式をかんがえたとしてもそれは酸性なんじゃないんですか?H2SiO3という式を見ても塩基性であることはよくわかりません。だとしたら弱酸のHFと反応するのはおかしいんじゃないだろうか、と思うのですが。
中和ではないですよ。
酸化還元反応でございます。
アンモニアも、極性は大きいけど水素結合があるから電離度が小さく、弱塩基になっているということですか?
アンモニアは水に溶けやすいことで有名ですが、電離度が小さいのに水に溶けやすいというのが頭の中でしっくりきません。
分子間の結合が強くても、各分子の極性が大きければ水には溶けるということであっていますか?
追加です。
頭の中のイメージだと
①水の中では、NH3のNと水分子のHが(どちらも極性を持つから)引き合おうとするけど
②水素結合(他のNH3分子のHと引き合うこと)によって水分子のHを引き付けにくくなる。つまり邪魔をする
③NH4+になり損なって電離度は低く、弱塩基となる。
④でも水分子と引き合いにくくなるなら水に溶けにくそう。
という感じです。文に番号をふったのは何番の文が間違ってるとか指摘しやすいと思ったのでそうしました。
こんにちは
質問なのですがハロゲン以外でも電気陰性度に関係なく安定の関係で族の周期表の下の方が酸性が強くなるのですか?
陰イオンの安定性が、F–<Cl–<Br–<I–
というのは、F-が最も不安定、ということですか?
イオン化した時の安定性とはどのようにわかるのでしょうか?
価電子が外側の方が原子一個にかかる影響が少なくなるのでしょうか?
イオン半径は小さい方が不安定です。
大きい方が安定です。
最外殻の電子と電子の距離が遠くなるので。
(もちろん、これはハロゲンの場合です。遷移金属を含めると必ずイオン半径が大きい方が安定かというと言い切れない部分もあります)
二酸化ケイ素にHFaqもしくはHF(気)を反応させるかで生成物が変わる理由がよく分かりました!
知り合いの中で疑問になって結局解決しなかったので助かります!!
水の電気分解の次に感動しました!
あおお、よかったです!
ありがとうございます!
陰イオン化傾向を考えるとClの方がBr,Iよりもイオンになりやすい、すなわちClの方がイオンの形で安定になると思ったのですが記事と矛盾するのは何故ですか?
>陰イオン化傾向を考えるとClの方がBr,Iよりもイオンになりやすい、すなわちClの方がイオンの形で安定になると思ったのですが記事と矛盾するのは何故ですか?
陰イオン化傾向だけでイオンの安定性は決まらないからです。
追加です。
電離度がより大きいということは、より強酸なのがHCl<HBr<HIということになるんですよね?
ちょっとショックです・・・(笑)
なんとなく気持ちがわかります。
オクテット構造が安定になると習ったのですが、clは安定しないのでしょうか?
オクテット構造が安定です。