高校で習う唯一の塩基性の気体『アンモニア』
このアンモニアは肥料として使われて、非常に重要な物質でした。また、もちろん入試でも重要で、入試でよくこのアンモニアの製法は問われます。
なので、キッチリ反応式や記述問題も解けるようにしてください!
目次
工業的製法:ハーバーボッシュ法
もはやクソみたいに反応式が簡単なこの工業的製法。
って言うシンプルすぎる考え方。化学反応式も驚くほどシンプルで
N2+3H2→2NH3
中学生でも作り出せるでしょう。
しかし、シンプルな考え方ですが、これが世紀の大発明!と言われるのはこの反応を実際におこすのが非常に難しいからです。
これがハーバーボッシュ法と言われています。ハーバーボッシュ法で入試で聞かれる重要な部分は別記事にまとめました。
「触媒」やら「ルシャトリエの原理」やら色々重要な部分が詰まっている工業的アンモニアの製法なのできっちりと読み込んでください。
実験室的アンモニアの製法
実験室的アンモニアの製法で有名なものを2つ紹介します。しかし、別に全力で覚える必要はありません。なぜなら弱塩基遊離反応なので、見れば反応式を作ることができます。
なので、弱酸遊離反応や弱塩基遊離反応についてキッチリまとめておく必要があります。
こちらの記事でキッチリ弱酸遊離反応、弱塩基遊離反応を頭に入れておいて下さい。
塩化アンモニウム+水酸化カルシウム
塩化アンモニウムト水酸化カルシウムを混ぜて加熱することで
2NH4Cl+Ca(OH)2→CaCl2+2H2O+2NH3
弱塩基の塩 強塩基の分子 強塩基の塩 弱塩基の分子
アンモニアが発生します。
本来弱塩基でイオン化するべきでない塩化アンモニウム(のび太)がイオン化して、強塩基である水酸化カルシウム(ジャイアン)が分子である。
その状況が許せないために、ジャイアンが塩になってやる!といってアンモニアを追い出す反応でした。これは、やはり弱酸遊離反応、弱塩基遊離反応をキッチリ理解しておく必要がありますね。
他にも、硫酸アンモニウムと水酸化ナトリウムを混ぜて加熱することで、アンモニアが弱塩基遊離反応によって反応します
(NH4)2SO4+2NaOH→Na2SO4+2H2O+2NH3
弱塩基の塩 強塩基の分子 強塩基の塩 弱塩基の分子
弱塩基のくせに塩になっている硫酸アンモニウム(のびた)。そして、強塩基なのに分子のままである水酸化ナトリウム(ジャイアン)。
これでジャイアンに追い出されて、アンモニアが遊離します。
アンモニア発生の実験装置
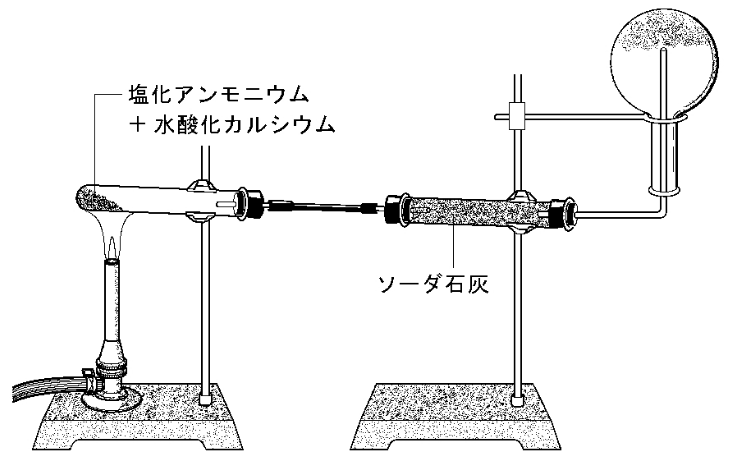 これは、アンモニアの製法は、水酸化カルシウム+塩化アンモニウムの発生に使われます。
これは、アンモニアの製法は、水酸化カルシウム+塩化アンモニウムの発生に使われます。
注意点
この実験で問われやすいポイントをまとめていきます!
①試験管の底部をやや高くする
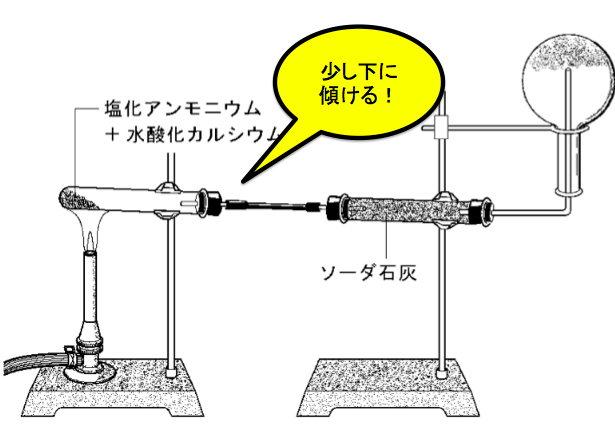
この注意点は、このように試験管を加熱する部分を上げて、試験管の口を下げるのです。この理由は、
2NH4Cl+Ca(OH)2→CaCl2+2H2O+2NH3
このように水が発生する反応なのです。すると、発生した水が試験管の熱しているところに流れ込んだら、熱せられている所の熱さと内側の水の内と外の温度差で試験管がわれちゃいます!
②乾燥剤ソーダ石灰を用いて気体を乾燥させる
この反応は、
2NH4Cl+Ca(OH)2→CaCl2+2H2O+2NH3
水が出来ちゃうねんな!つまり、純粋なアンモニアが手に入れられずに、混合物になってしまうんですよね。だから水を取り除かないといけないんです。
そこで、ソーダ石灰を使います。アンモニアは塩基性の気体なので、塩基性の乾燥剤を使いましょう!酸性乾燥剤だと中和反応が起こってしまいます!
ソーダ石灰に付いて詳しく知りたい方はこちら
気体発生装置で加熱が必要なものは、気体発生装置で加熱で必要なものに関してはコチラをご覧下さい。
アンモニアの検出方法
発生した気体がちゃんとアンモニアだよね!ってことを確かめる必要がありますよね。その方法が2つあります。
基本的に、1つ目が重要ですが、どの教科書でも2つ目も書かれていますし、たま〜に選択問題レベルなら2つ目も出ます。なので、記憶の片隅に引っかかる程度に覚えておいてください。
①塩化水素反応させて白煙が発生する
アンモニアに塩化水素を反応させると、
NH3+HCl→NH4Cl
の反応がおこります。このNH4Clの微小なイオン結晶によって白煙のように見えます。
②ネスラー試薬を加えると黄褐〜赤褐色沈殿が生じる
最近はネスラー試薬は毒性や環境汚染の影響で使われることが無くなりました。
なので、正誤問題にちょろっと出てくる程度です。
ネスラー試薬=アンモニアの検出反応であると覚えておけば十分です!こんなところに時間と脳みその容量をつかっても仕方がありません
まとめ
アンモニアの製法やその方法の注意点をまとめてみました。特に難しい内容でもないですし、気体の製法で覚えるような化学反応式もありません。
このようにキッチリ理解しながら学んでいきましょう!!それでは!!



















アンモニアの製法で、NH4Cl+NaCl の場合、水を加えるように書いてあったのですが、これはなぜでしょうか。