どうも、受験化学コーチなかむらです。


気体の製法の問題を見たら、『覚えよう』とする人が大半です。頑張って覚える方法を探している人がいます。

本記事では気体の製法の化学反応式を暗記するのではなく作り上げる方法をご紹介します。
実は丸暗記することはほとんどないです。

目次
受験テク!気体の製法の考え方!
気体の製法の化学反応式は暗記するのではなく、その場で作り出しましょう!
受験化学の世界では残念ながら覚えなければならない反応も存在します(主に工業的製法のような無理やり起こす反応)。しかし、気体の製法は違います。
これまで学習してきたであろう化学基礎や理論化学の知識で作り出すことができます。


なので、わざわざ暗唱したり、ムリやり語呂を作って覚えるのは愚策なんだ。暗記して書けるようにするのではなくて、ちゃんと作れるようにしていこう!
気体の製法4パターン
気体の製法は大きく分けると4つのパターンになります。
この4つのパターンもそれぞれそれほど難しいものではありません。以下の4つです。それぞれを詳しく解説していきます。

それでは1つずつ確認していきましょう。
酸化還元反応
酸化還元の化学反応は、「還元剤が酸化剤に電子をぶん投げる反応」です。
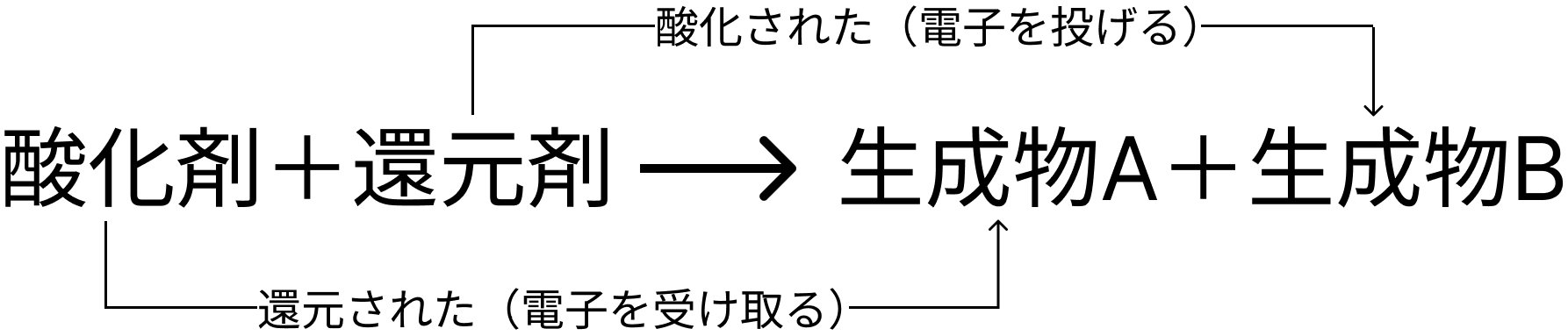
これを分解すると、
- 還元剤が電子を投げる反応
- 酸化剤が電子を受け取る反応
この2つに分けられます。
この酸化還元の反応を利用して気体が発生する反応をいかにまとめていきます。
化学基礎で酸化還元をきっちり勉強してきた人は、気体の生成反応で化学反応式を丸暗記する必要はありません。自分で作り出すことができます。
まだ酸化還元反応について詳しく理解していない人は別の記事で酸化還元の定義や半反応式の作り方を解説しています。ぜひこちらもあわせてお読みください。
では、酸化還元反応を応用して気体を生成する化学反応式をまとめていきます。
酸化還元反応を応用して気体を生成する反応のパターンは4つです。
- 水素よりイオン化傾向が大きい金属と酸の反応
- 水素よりイオン化傾向が小さい金属と酸化力をもった酸の気体生成反応
- 両性元素の単体の溶解による気体生成反応
- 酸化マンガン(IV)が絡む気体生成反応
- 自己酸化還元反応
1.水素よりイオン化傾向が大きい金属と酸の反応
水素よりイオン化傾向が大きい金属(K~Pb)に塩酸や希硫酸などを加えると水素が発生します。 具体例として亜鉛Znを使います。
具体例として亜鉛Znを使います。
亜鉛が電子を投げて水素イオンがキャッチすることで水素が発生します。
還元剤:Zn→Zn2++2e–
酸化剤:2H++2e–→H2
化学反応式:Zn+2HCl→ZnCl2+H2
H+が欲しい場合は酸性物質です。H+が電離している必要があるので、強酸のHClやH2SO4を使います。
| 発生する気体 | 試薬① | 試薬② | 化学反応式 |
| H2 | Mg | HCl | Mg+2HCl→MgCl2+H2 |
| Zn | HCl | Zn+2HCl→ZnCl2+H2 | |
| Zn | H2SO4 | Zn+H2SO4→ZnSO4+H2 | |
| Fe | H2SO4 | Fe+H2SO4→FeSO4+H2 |
2.水素よりイオン化傾向が小さい金属と酸化力をもった酸の気体生成反応
水素よりイオン化傾向が小さい金属は希酸には溶けません。しかし、酸化力のある酸(希硝酸HNO3、濃硝酸HNO3、熱濃硫酸H2SO4)には溶けます。

よく出る反応が銅に熱濃硫酸を加えると二酸化硫黄SO2が発生する反応です。
還元剤:Cu→Cu2++2e–
酸化剤:H2SO4+2e–+2H++→SO2
化学反応式:Cu+2H2SO4→CuSO4 + 2H2O + SO2↑
| 発生する気体 | 試薬① | 試薬② | 化学反応式 |
| 二酸化硫黄SO2 | Cu | 熱濃H2SO4 | Cu+2H2SO4→CuSO4+2H2O+SO2 |
| Ag | 熱濃H2SO4 | 2Ag+2H2SO4→Ag2SO4+ | |
| 一酸化窒素NO | Cu | 希HNO3 | 3Cu+8HNO3→3Cu(NO3)2+4H2O+2NO |
| Ag | 希HNO3 | 3Ag+4HNO3→3Ag(NO3)+2H2O+NO | |
| NO2 | Cu | 濃HNO3 | Cu+4HNO3→2H2O+2NO2 |
| Ag | 濃HNO3 | Ag+2HNO3→AgNO3+H2O+NO2 |
化学反応式の丸暗記は絶対にやめてくださいね!
半反応式さえ作れたら、覚えなくてもその都度作り出せます。無駄な暗記で時間を費やしている暇はないのです。
3.両性元素の単体の溶解による気体生成反応
両性元素は強酸、強塩基の両方で反応します。強酸との反応は「1.水素よりイオン化傾向が大きい金属と酸の反応」で解説済みです。
両性元素の化学反応式の作り方のポイントは『まずは水と反応させて水酸化物を生成する』ことです。
Zn+2H2O→Zn(OH)2+H2
強酸との反応の場合は以下のように中和反応っぽく反応させます。
Zn+2H2O→Zn(OH)2+H2・・・①
Zn(OH)2+2HCl→ZnCl2+2H2O・・・②
①は亜鉛と水の反応、②は水酸化亜鉛と塩酸の反応
①+②を足し合わせると以下のような化学反応式になります。
Zn+2HCl→ZnCl2+H2
酸だけでなく強塩基を加えても同じように気体が発生します。
Zn+2H2O→Zn(OH)2+H2・・・①
Zn(OH)2+2NaOH→Na2[Zn(OH)4]+H2↑
両性元素の水酸化物に強塩基を加えると錯イオンができます。
そしてついでに水素が発生します。
4.酸化マンガン(IV)が絡む気体生成反応
Cl2やO2の発生に共通して用いられる試薬であるMnO2、それぞれの場合で働きが異なります。
還元剤:2Cl–→Cl2+2e–
酸化剤:MnO2+2e–+4H+→Mn2++2H2O
化学反応式:MnO2+4HCl→MnCl2+Cl2+2H2O
5.自己酸化還元反応
自己酸化還元反応とは、同じ元素同士で酸化還元反応を起こす反応です。気体の製法では以下の組み合わせの酸化還元反応で自己酸化還元反応が起こります。
- 塩化水素と次亜塩素酸
さらし粉(CaCl(ClO)・H2O)に塩酸(HCl)を加えると塩素が発生します。
ステップ1:弱酸遊離反応で次亜塩素酸を遊離する
ステップ2:自己酸化還元反応で塩素が発生する
ステップ1:弱酸遊離反応で次亜塩素酸を遊離する
CaCl(ClO)・H2O+HCl→CaCl2+HClO+H2O・・・①
次亜塩素酸は弱酸です。それなのにClO-はイオン化しています。よって、塩化水素が次亜塩素酸の分子を高めます。
HCl+HClO→Cl2+H2O・・・②

しかし、ClO–とCl–が酸化還元反応をすると、ちょうど間の酸化数ゼロの塩素になるのです。

CaCl(ClO)・H2O+HCl→CaCl2+HClO+H2O・・・①
HCl+HClO→Cl2+H2O・・・②
①+②より、
CaCl(ClO)・H2O+2HCl→CaCl2+Cl2+2H2O
となります。
このように酸化数が異なる同じ元素が酸化還元反応を起こして、中間の酸化数に落ち着く現象を利用した気体の製法も存在します。
より詳しくは、「さらし粉」を徹底解説している記事をお読みください。
弱酸(弱塩基)遊離反応
『弱酸の塩 + 強酸 → 強酸の塩 + 弱酸↑(気体発生)』
『弱塩基の塩 + 強塩基 → 強塩基の塩 + 弱塩基↑(気体発生)』
弱酸の塩に強酸を加えると強酸が塩になり弱酸が追い出されて出てきます。(塩基でも同じ反応が起きます。)
弱酸遊離反応はジャイアンとのび太の関係に似ています。
強酸、強塩基=ジャイアン
・・・電離度が大きいのでイオンでありたい。
弱酸、弱塩基=のび太
・・・電離度が小さいのでイオン化せず分子であるべき。
強酸ほど電離しやすく、弱酸ほど電離しにくいのです。
弱酸遊離反応はこの原理原則が歪んだ状態に起こります。実例を見てみましょう。
CH3COONa(イオン)+HCl(分子)→CH3COOH+NaCl
弱酸の塩に強酸を加えると弱酸が追い出されて強酸が新たな塩になる。
左辺では酢酸ナトリウムCH3COONaがイオンで、塩化水素HClが分子です。


弱酸がイオンになっていて、強酸が分子になっているんだ。本来は強酸の塩化水素HClがイオン化していて、弱酸の酢酸CH3COOHになっているべきだよね!
酢酸ナトリウムは塩化水素を差し置いてイオン化しています。
弱酸のくせにイオン化しているのび太(CH3COO-)をジャイアン(HCl)は許しません。
ジャイアンがのびたをイオンから追い出して、のびたを分子にするのです。
動画でも解説しておりますので、こちらをご覧ください。
ちなみに本サイトでは弱酸(弱塩基)遊離反応をジャイアントのび太の関係を使って解説しています! 弱酸遊離反応を理解できてない人は次の記事を読んでおいてくださいね!
では具体的に弱酸遊離反応、弱塩基遊離反応で気体を生成する反応をまとめていきます。
硫化水素H2S
硫化水素H2Sは弱酸です。
例えば強酸の塩酸をぶっかけたら、以下のような反応で硫化水素を生成することができます。
S2-+2HCl→FeCl2+H2S↑
よくあるのは硫化鉄に強酸をぶっかけて硫化水素を生成する反応です。化学反応式は以下のように作ることができます。
FeS+2HCl→FeCl2+H2S
このように作ることができます。
強酸だったらなんでも良いのか?
強酸の中でもお手軽に使えるのは塩酸です。気体の製法は学校の理科室でやるレベルの実験なので、学生でも使いやすい塩酸を使うことが多いです。
二酸化炭素CO2
二酸化炭素は炭酸カルシウム(CaCO3)に強酸の塩酸(HCl)を加えると、弱酸の炭酸(H2CO3)が遊離して発生します。
CaCO3+2HCl→CaCl2+H2CO3
生成した炭酸は不安定です。生成された途端に水と二酸化炭素に分解されます。
H2CO3→H2O+CO2
このように二酸化炭素が生成されます。
アンモニアNH3

塩化アンモニウムと水酸化カルシウムを混合することでアンモニアが発生します。
弱塩基のアンモニウムイオンが水酸化カルシウムによって取り出されます。
NH4Cl+Ca(OH)2→CaCl2+NH3+H2O
この反応を進めるには「加熱」が必要です。塩化アンモニウムと水酸化カルシウムは両方とも固体です。
「実験器具」と「加熱の有無」の関係については、「加熱の有無で区別する気体の生成反応の実験器具総まとめ」の記事で解説しています。
加熱が必要な実験器具に関して全て網羅して学べるのでぜひこの記事も熟読してください!
塩素Cl2
塩素はさらし粉に塩酸を混ぜることで発生します。
CaCl(ClO)・H2O+2HCl→CaCl2+Cl2+H2O
先ほどの「自己酸化還元反応」のところでも解説しましたが、さらし粉+塩酸の反応は単純な弱酸遊離反応ではありません。酸化還元反応との組み合わせです。
CaCl(ClO)・H2O+HCl→CaCl2+HClO+H2O・・・①
厳密には弱酸遊離反応と酸化還元反応が順番に起こって塩素が発生します。
詳しくは次の記事でまとめています。
揮発性酸遊離反応
揮発性酸の塩+不揮発性酸→不揮発性酸の塩+揮発性酸↑
揮発性酸とは塩化水素HClや硝酸HNO3、フッ化水素HFのような酸で、蒸発しやすい酸性物質のことです。一方で硫酸は不揮発性の酸です。
揮発性酸遊離反応とは弱酸遊離反応の応用バージョンです。



塩化水素は硫酸に比べたら弱酸なので、塩化水素は追い出されます。でもそれは硫酸の第1電離までの話で、第2電離よりは塩化水素の方が強いんだ。
H2SO4の第1電離 > HClの電離 > H2SO4の第2電離
NaCl(強酸の塩)とNaHSO4(弱酸)が溶液中にある状態だよね。
HSO4–よりも強酸のHClが塩としてイオン化している状態は正しいんだ。
揮発性酸遊離反応で発生する気体と化学反応式は以下の通りです。
| 試薬① 揮発性の酸の塩 |
試薬② 不揮発性の酸 |
化学反応式 | |
| HCl | NaCl | H2SO4 | NCl+H2SO4→NaHSO4+HNO3 |
| HNO3 | NaNO3 | H2SO4 | NaNO3+H2SO4→NaHSO4+HNO3 |
| KNO3 | H2SO4 | KNO3+H2SO4→KHSO4+HNO3 | |
| HF | CaF2 | H2SO4 | CaF2+H2SO4→CaSO4+2HF |
揮発性酸遊離反応について詳しくは以下の記事で解説しています。
もっと深く揮発性酸遊離反応を知りたい人はぜひこちらをお読みください。
分解反応
分解反応とは原子や分子がくっついている状態から、バラバラになる反応のことです。

中学生の時に「炭酸水素ナトリウムを加熱すると炭酸ナトリウムと水と二酸化炭素が生成される」という反応を覚えさせられた記憶はありますでしょうか?
2NaHCO3→Na2CO3+H2O+CO2
この化学反応式を覚えた人も多いでしょう。
この反応が分解反応です。炭酸水素ナトリウムという1つの物質が3つくらいにバラバラになる反応です。
また、このような分解反応は加熱が必要になることが多いです。(例外もあります。)
窒素N2
窒素N2は亜硝酸アンモニウム(NH4NO2)の熱分解で生成されます。
アンモニウムイオンNH4+と亜硝酸イオンNO2–には両方とも窒素が含まれてます。
同じ窒素でも酸化数が異なります。アンモニウムイオンNH4+は-3、亜硝酸イオンNO2–は+3です。

アンモニウムイオンと亜硝酸イオン同士が酸化還元反応をします。

酸化数-3と酸化数+3が酸化還元反応して酸化数0の窒素が生成されます。
NH4NO2→N2+2H2O
一酸化炭素CO

ギ酸を濃硫酸で脱水すると一酸化炭素COが生成されます。

このように反応します。
一酸化炭素について詳しく知りたい方は以下の記事をチェックしてみてください。
酸素O2
これ中学生の時に暗記しましたよね?
H2O2は酸化剤にも還元剤にもなれる物質でした。


オキシドールに二酸化マンガンを加えて酸素を発生させる反応は、実はH2O2の酸化剤の反応とH2O2の還元剤の反応が同時に起こる反応なのです。
この2つの半反応式を作成します。
還元剤:H2O2→O2+2H++2e–
酸化剤:H2O2+2H++2e–→2H2O
これら2つをまとめると以下のような化学反応式が出来上がります。
2H2O2→2H2O+O2
これ小学校や中学校の時に覚えるくらいにみたと思います。こうやって作ることができます。
この反応は加熱は不要です。

元素別の気体の製法まとめ
ここまでは「反応の種類」で気体の製法をまとめてきました。
ここまでだけでも十分問題に対応できるでしょう。
ただ、入試問題では「元素ごと」に出題されることもあります。窒素、硫黄、塩素は気体の生成反応の問題で頻出です。これらは別途まとめておきます。
窒素
NH4Cl→NH3
塩化アンモニウムに水酸化カルシウムのような強塩基を加えると、弱塩基のアンモニアが生成されます。
2NH4Cl+Ca(OH)2→2NH3+CaCl2
亜硝酸アンモニウムの熱分解(NH4NO2→N2)
亜硝酸アンモニウム(NH4NO2)を熱分解することで窒素が発生します。
NH4+とNO2-の酸化還元反応です。

熱分解されて窒素が発生します。
HNO3→NO2またはHNO3→NO
濃硝酸+CuやAgの酸化還元反応はNO2
希硝酸+CuやAgの酸化還元反応はNO
濃硝酸や希硝酸の半反応式は以下のように覚えます。

詳しいことは以下の記事で確認してみてください。
これらの窒素関係の記事をまとめると、

窒素関連の気体の製法で出てくる硝酸は「ソルベー法」で作られます。ソルベー法についても詳しく解説しているので、以下の記事でぜひ確認しておいてください。
硫黄
FeS→H2S
硫化鉄に強酸を加えると弱酸遊離反応でH2Sが生成されます。
FeS+2HCl→H2S+FeCl2

H2SO4→SO2
熱濃硫酸は酸化剤として二酸化硫黄が生成されます。
半反応式は以下のようになります。
銅のような金属と熱濃硫酸の酸化還元反応ができるとしたらそういうことになります。
熱濃硫酸の半反応式の作り方〜なぜ濃硫酸や希硫酸は酸化剤ではない理由〜
Na2SO3→SO2
亜硫酸ナトリウムの亜硫酸(H2SO3)は弱酸です。
弱酸遊離反応で亜硫酸を遊離することができます。
Na2SO3+2HCl→H2SO3+2NaCl・・・①
H2SO3→H2O+SO2・・・②
①+②をすると
Na2SO3+2HCl→H2O+SO2+2NaCl・・・③
このようにして亜硫酸ナトリウムの弱酸遊離反応で二酸化硫黄が発生します。
これらの硫黄の反応を画像1枚にまとめると以下になります。矢印の反応を説明できるように復習しておきましょう!

塩素

①Cl–→HCl
イオンの塩化物イオンが分子の塩化水素になっています。
これは弱酸遊離反応です。塩化水素が弱酸として扱われるのは、濃硫酸の時だけです。つまり、揮発性酸遊離反応です。
NaCl+H2SO4→NaHSO4+HCl
このような反応になります。
②MnO2+HCl→Cl2
酸化マンガンに塩化水素を加えて塩素を発生させる反応です。
塩素の酸化数が変わっていることから、酸化還元反応です。
還元剤:2Cl-→Cl2+2e–
酸化剤:MnO2+4H++2e–→Mn2++2H2O
足し合わせると
MnO2+2H++2HCl→Mn2++Cl2+2H2O
になります。
最後に
- 気体の製法は既習の知識の組み合わせで対応可能
- 酸化還元反応
- 弱酸遊離反応
- 揮発性酸遊離反応
- 分解反応
- 元素別でも気体の製法は出題される
いかがでしたか?
気体の生成反応は高い頻度で入試で出題されます。細かい反応の知識だけでなく、本記事のように全体像を把握しておきましょう。
また、全てを丸暗記する必要はなくその都度化学反応式は作っていきましょう。



















