こんにちは。




ナトリウム単体は天然には存在しません。
身の回りにあるナトリウムは、すべて塩化ナトリウム(食塩)や炭酸水素ナトリウムなどの「化合物」です。
しかしナトリウム単体にはユニークな性質があり、工業的には有用な物質です。
そこで、ナトリウムの単体は「溶融塩電解(融解塩電解)」という特殊な操作によってつくられています。
それはいったいどのような手法なのでしょうか?
そして作られたナトリウム単体は何に使われるのでしょうか?
この記事で徹底解説していきます!
目次
ナトリウム単体の精製が難しい理由
ナトリウムのようなアルカリ金属やアルカリ土類金属にはイオン化傾向が大きいという共通性質があります。
Li > K > Ca > Na > Mg > Al > Zn > Fe > Ni > Sn > Pb > H > Cu > Hg > Ag > Pt > Au
(太字がアルカリ金属とアルカリ土類金属)
そのためナトリウムは陽イオンにきわめてなりやすく、反応性が非常に高いのです。
これがナトリウム単体を日常生活で目にすることがほとんどない理由なんですね。
ナトリウム単体を空気中に置いておくと、すぐに空気中の酸素と反応して酸化ナトリウムになります。
4Na + O2 → 2Na2O
また水とは激しく反応し、水酸化ナトリウムと水素ガスを生じます。
2Na + H2O → 2NaOH + H2↑
そのため実験室では、水や空気に触れないよう石油中に保存するのです。
ではなぜナトリウムはイオン化傾向が大きく、反応性が高いのでしょうか?
それは「原子半径が大きく価電子が1つしかない」からです。

原子半径が大きいということは、この電子は中心にある原子核から遠く離れた位置にいます。
電子は遠くにあればあるほど原子核に引きつけられる力が弱まります。しかも最外殻には1つしか電子がないのです。
この電子が容易に他の原子に奪われてしまうのは理解できますね。
でもなぜアルカリ金属は原子半径が大きくなるのでしょう?
電子をたくさん持っている方が大きくなりそうですよね?
実は原子半径は電子の数だけでなく、原子核の持っている電気の強さでも決まります。
アルカリ金属の原子核の持つ電荷は、同じ周期の元素の中で一番小さいですよね?
例えばナトリウムの原子核が持つ電荷は+11、マグネシウムは+12、アルミニウムは+13です。
電荷が少なく電子を引き寄せる力が弱いナトリウムの原子半径は、マグネシウムやアルミニウムより大きくなるのです!
これがアルカリ金属の原子半径が大きく、電子を手放しやすい=反応性が大きい理由なんですね!
ナトリウムの溶融塩電解(融解塩電解)とは
このようにイオン化傾向が大きく反応性に富むナトリウム単体は、天然には存在しません。
「融解塩電解」は天然にあるナトリウム化合物から無理やり電気の力でナトリウム単体を取り出す方法なのです!
地球上にあるほとんどのナトリウムは、化合物である塩化ナトリウム(NaCl)として海水中などに含まれています。

では塩化ナトリウムから、どうやってナトリウム単体をとりだしたらいいのでしょう?
ここで「電気分解」がひらめいたら、化学道を極めつつあるといっても過言ではありません!
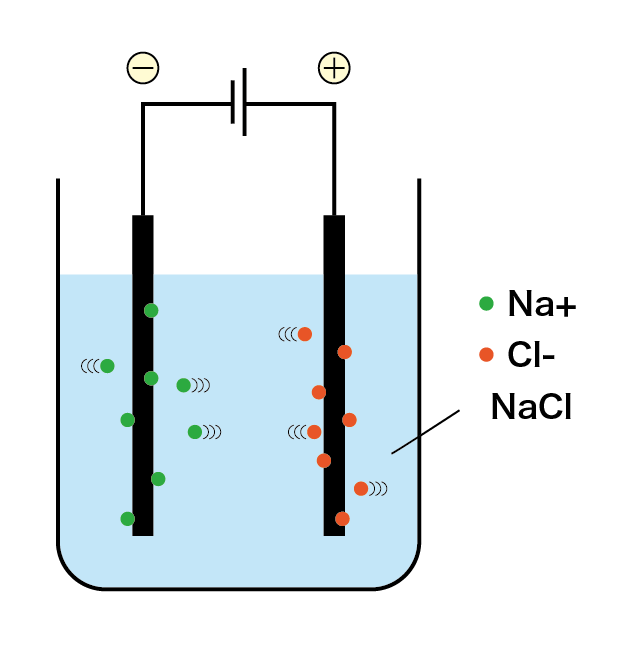
では塩化ナトリウム水溶液を電気分解すると、どうなるか考えてみましょう!
水溶液中には陽イオンとしてNa+とH+が、陰イオンとしてCl–とOH–が存在しています。
陰イオンは陽極に引き寄せられ、イオン化傾向がより小さいCl–が電子を手放し塩素ガス(Cl2)が発生します。(陰イオンにもイオン化傾向があります。)
陽イオンは陰極に引き寄せられ、イオン化傾向がより小さいH+が電子を受け取り水素ガス(H2)が発生します。

水溶液中にはNa+とOH–が残され、水酸化ナトリウム水溶液(NaOH)ができます。
この反応を化学反応式で表すとこうなります。
2NaCl + H2O → 2NaOH + Cl2 + H2
つまり通常の電気分解ではナトリウム単体は精製できません!
そこで考えられたのが「水を入れない」方法です!
「陽イオンがNa+しかなかったら、Na+が発生するしかない」ですよね。
塩化ナトリウムの融点である「800℃」(超高温!)になるまで熱を加え、融解させた塩化ナトリウムに、そのまま電圧をかけ電気分解します。
すると陽極側には塩素ガス(Cl2)が、負極側にはナトリウム単体が生成するのです!
(陽極)2Cl– → Cl2 + 2e–
(陰極)Na+ + e– → Na
(全体)2NaCl → 2Na + Cl2
この手法によってナトリウム単体が工業生産されています。
ナトリウム単体の使用例
融解塩電解によって作られたナトリウム単体=金属ナトリウムは一体どのような用途に用いられるのでしょう?
金属ナトリウムは融点が98℃と低いため、温度を上げると「液体金属」になります。
流動性があり、熱伝導率が高い金属ナトリウムは「原子炉の冷却材」に使われています。
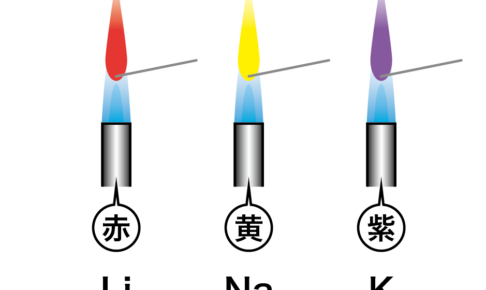
また街灯やトンネルでよく使われている黄色の照明は、ナトリウムの蒸気を使った「ナトリウムランプ」です。

ナトリウムの炎色反応は「黄色」ですよね。

(アルカリ金属の炎色反応について詳しく知りたい人は、こちらの記事を読んでみてください。)
この黄色い光は「熱」だけでなく、「電気」で発生させることもできます。
「ナトリウムランプ」は電球の中に少量のナトリウムの蒸気を入れることで、この黄色い光を出せるようにした照明器具です。
黄色い光は白い光よりも霧や煙の影響を受けにくく、遠くまで照らすことができるので街灯やトンネル内で使われているのですね。
まとめ
この記事では、ナトリウム単体の性質、精錬方法「融解塩電解」、そして使用例について解説しました。
ナトリウム単体は、
原子半径が大きく価電子が1つしかないので、電子を失いやすく反応性が高い
のが特徴です。
溶融塩電解(融解塩電解)は、
塩化ナトリウムを水溶液にせず、融解させて電気分解することによりナトリウム単体=金属ナトリウムを得る手法
です!
ナトリウム単体は、
- 融点が低い性質から原子炉の冷却材に
- 電圧をかけると発生する特有の黄色い光が街灯に
用いられています!