どうも、受験化学コーチなかむらです。


受験に頻出の「炭酸ナトリウム」と「炭酸水素ナトリウム」。
ややこしい性質の違いをしっかり整理しておきましょう!
この記事では炭酸ナトリウムの性質や製法、入試出題ポイントそして炭酸水素ナトリウムとの違いを分かりやすく解説します!
目次
炭酸ナトリウムの化学式・式量・用途
炭酸ナトリウム(Na2CO3)は、アルカリ金属であるナトリウムイオン(Na+)と炭酸イオン(CO32–)が1:2の割合でイオン結合した炭酸塩です。

化学式(組成式)は、Na2CO3
式量は、106(イオン結晶なので「分子量」ではありません)
常温常圧では白色の固体です。

ガラスの原料、洗濯洗剤、こんにゃくの凝固剤、中華麺のかん水などとして用いられています。
古代エジプトではその脱水作用を利用して、ミイラ作りの時の乾燥剤に使われていたようです。

炭酸ナトリウムの性質
水溶性
水への溶解度は20℃で220g/lと、比較的水によく溶けます。

一般的に炭酸塩は水に溶けないのですが、アルカリ金属の炭酸塩だけは水に可溶です。
その理由はアルカリ金属のイオンが一価なのでクーロン力も小さく、またイオン半径も小さいので結晶内部の原子間のすき間が大きいためです。
またイオン化傾向が大きいことも、要因の一つになっています。
アルカリ金属の性質について詳しく知りたい人はこの記事を読んでみてください。
塩基性
水に溶けると塩基性を示します。

「え? NaOHみたいに水酸化物イオンを持ってるわけじゃないのに塩基性になるの?」
と思うかもしれませんが、炭酸ナトリウムは加水分解によって水酸化物イオン(OH–)を生じるのです!
「水に溶ける」とは、ナトリウムイオン(Na+)と炭酸イオン(CO32–)が水分子によって結晶から引きはがされるということ。
Na2CO3 → 2Na+ + CO32–
引きはがされた炭酸イオンのほとんどは水分子から水素イオン(H+)を奪い、より安定した炭酸水素イオン(HCO3–)になります。
CO32– + H2O → HCO3– + OH–
これによって水酸化物イオン(OH–)が出来るので、水溶液は塩基性になります。
風解
炭酸ナトリウム水溶液を乾燥させると、水分子を水和水として取り込みます。
そして透明な炭酸ナトリウム十水和物Na2CO3・10H2Oの結晶が析出します。
この結晶を乾燥した空気中に放置すると、徐々に水和水を失って白色粉末の炭酸ナトリウム一水和物Na2CO3・H2Oに変化します。

このような現象を「風解」といいます。
風解は結晶表面の水蒸気圧が大気中の水蒸気圧より大きいために起きるので、密閉容器に保存すれば防ぐことができますよ。
風解は炭酸ナトリウム以外の物質も起こします。風解という現象だけを詳しく解説している記事も作成しました。興味がある人はこちらもご覧ください。
炭酸ナトリウムと炭酸水素ナトリウムとの違い
名前の似ている炭酸ナトリウム(Na2CO3)と炭酸水素ナトリウム(NaHCO3)はどちらも白色粉末なので見た目で区別するのは難しいです。
しかし性質は全然違います!
炭酸ナトリウムと炭酸水素ナトリウムの違いを表にまとめてみました!
| 炭酸ナトリウム | 炭酸水素ナトリウム | |
| 別名 | 炭酸ソーダ | 重曹 |
| 水溶性 | 水によく溶ける | 水に少し溶ける |
| 塩基性 | 強い | 弱い |
| 風解性 | あり | なし |
| 熱反応性 | 熱しても分解しない | 熱すると分解して、炭酸ナトリウム・二酸化炭素・水を生じる |
この中で特に重要なのは「水溶性」と「塩基性」です。
炭酸ナトリウムは炭酸水素ナトリウムより水に溶けやすく、塩基性も強いことをしっかり押さえておきましょう!
え? そんなこと言われても頭に入ってこないって?
そんな時は「ゴロ合わせ」だ!
なつこさんは水曜に延期
(Na・2・CO・3 は 水溶 に 塩基)
「なつこさんは最近忙しいので、美容院の予約を水曜に延期した」ようなイメージです。

Na2CO3(なつこさん)は水溶性があり、水に溶けると強い塩基性を示すことが覚えられたらばっちりです!
炭酸水素ナトリウムの性質についてより詳しく知りたい人はこの記事を読んでみてください。
炭酸ナトリウムの工業的製法
炭酸ナトリウムは天然から採掘されるほか、工業的にアンモニアソーダ法で作られています。
アンモニアソーダ法は発明者の名前をとってソルベー法とも呼ばれ、食塩水から低コストで大量生産が可能な方法です。
反応のステップは以下のとおり。
1・石灰石を熱して二酸化炭素を発生させる。
CaCO2 → CaCOCO2
2・アンモニアを溶かした食塩水に二酸化炭素を通し、炭酸水素ナトリウムを沈殿させる。
NaCl + NH3 + H2O + CO2 → NaHCO3 + NH4Cl
3・この炭酸水素ナトリウムを回収して加熱すると、炭酸ナトリウムができる。
2NaHCO3 → Na2CO3 + H2O + CO2
結構シンプルな反応ですね!
でもソルベー法のすごいところはココからです。
4・ステップ1の反応で残った酸化カルシウムを水と反応させ、水酸化カルシウムを作る。
CaO + H2O → Ca(OH)2
5・ステップ2の反応で残った塩化アンモニウムをこの水酸化カルシウムと反応させ、ステップ2で使うアンモニアを作る。
2NH4Cl + Ca(OH)2 → CaCl2 + 2H2O + NH3

なんと副産物から反応に必要な物質を取り出して、再利用することができるのです。
なんという無駄のなさ!
鳴き声以外は全部食べる沖縄の豚のようですね。
ソルベー法については下の記事でより詳しく説明していますので、ぜひ読んでみてください。
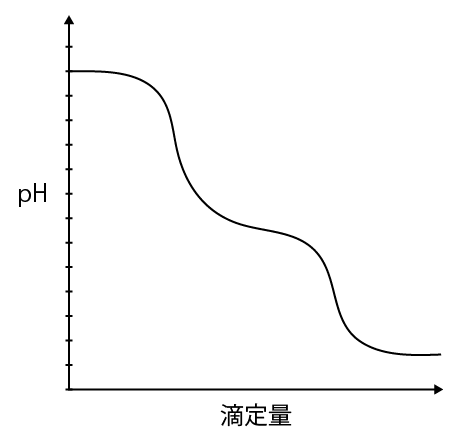
炭酸ナトリウムの二段滴定と滴定曲線
二段滴定とその滴定曲線は「酸・塩基」の単元でよく出てきます。
ポイントは炭酸ナトリウムが2ステップで中和されるということ。
炭酸ナトリウム水溶液を塩酸によって滴定した時、どのような反応が起きるのか実際に見ていきましょう。
ステップ1 – 炭酸ナトリウムが炭酸水素ナトリウムと食塩になる
Na2CO3+HCl → NaHCO3+NaCl
この反応によって滴定曲線は一つ目の急降下を示します。

この部分の中和はフェノールフタレインを指示薬をして用いることで検出できます。
ステップ2 – 炭酸水素ナトリウムが炭酸と食塩になる
NaHCO3+HCl → H2CO3+NaCl
この反応によって滴定曲線は二つ目の急降下を示します。
この部分の中和の検出には、メチルオレンジを用います。
トータルでの化学反応式は
Na2CO3+2HCl → H2CO3+2NaCl
になります。
炭酸ナトリウムの二段滴定の実践的な受験テクニックは、この記事で詳しく解説しています!
まとめ
炭酸ナトリウムの代表的な性質は
- 水に溶けやすい
- 水溶液は塩基性を示す
- 十水和物は風解する
です!
炭酸ナトリウムの工業的製法は
- アンモニアソーダ法(ソルベー法)
です!
この記事の途中で紹介しているソルベー法は非常に重要です。ソルベー法を理解しつつ、ゴロで覚える方法もご紹介している記事ですので、こちらの記事をご覧ください。
このほかアルカリ金属に関して重要ポイントを全て1つの記事にまとめました。
- ソルベー法
- アルカリ融解法
- 熱分解
- 融解塩電解
これらアルカリ金属で出題される全ての内容を1つの記事にまとめました。ぜひこちらをご覧ください。