こんにちは。
NaOHの工業的製法としてイオンン交換膜法というのが現在使われています。
で、無機化学を勉強する人におおいのが、「これは特殊な方法だから覚えないと!!」となってしまうことです。非常に多くて困ります。
ちゃんと電気分解の知識を使えば余裕です。
それでは、詳しく見ていきましょう!
目次
NaOHの電解精錬の理念
工業的製法は、ほとんど同じような理念があります。それは、『安い材料でええもん作りましょ!』です。
そして、アンモニアソーダ法(ソルベー法)でもつかわれた安いざいりょうですが、それはNaClです。

こんなもの海からいくらでも取れます。
「これと水で、NaOH作れたら素敵だな〜」というのがこの陽イオン交換膜法の理念です。
陽イオン交換膜法の様子
まずこれは電気分解ですので、電子が流れる向きを矢印を書いて確認しなければなりません。

このようになります。
つまり、ちゃんと覚えていなくても、陽極は還元剤と言う事がわかります。
陽極の反応
陽極の序列は、極板>溶液中のハロゲン>水でした。
今回陽極の炭素は超高温でないと、電子を放出しないので、極板ではない。すると溶液中のハロゲンと言う事になります。
2Cl–→Cl2+2e–
という反応である事がわかります。
そして次は陰極ですが、陰極は電子を受け取るので酸化剤です。
陰極の反応は、極板は関係ありませんでした。
そして、溶液中に~iumがつくものは電子を受け取りませんので、Na++e–→Naと言う反応は起こりえません。アルカリ金属が電子を受け取るなんてことはありません。
陰極の反応
陰極の反応の序列ですが、Ag+>Cu2+>H+です。今回Ag+やCu2+はないので、しかも塩基性なので(希水酸化ナトリウム)を溶かし込んでいる状態です。
なので、水が反応します。
2H2O+2e–→H2+2OH–
と言う反応が起ります。
この水の反応式も覚えようとする人が非常に多いですが、全くそんなことをする必要はありません。
今回だと、電子を受け取れるのは、H+しかありませんからまずH+が電子を受け取って水素H2が出来るという反応式を作ります
2H++2e–→H2
しかし、酸性条件ではないので、このように水素イオンが電子を受け取ることはめったにありません。だから、こういうときは、両辺にOH–を足してH+をH2Oに変えるのです。
すると2H2O+2e–→H2+2OH–になります。
こんなかんじで水が絡んでくる反応式を作る方法はすべて覚える必要がないです。
水が絡んでくる半反応式の書き方はこうやれ!を参照してください!
簡単な図で見るイオン交換膜法
わかりやすくするために、先程よりも簡単な図で表していきます。
右側が陰極(電子を受け取る側)で左側が陽極(電子を投げる側)です。

すると、このように反応していきます。
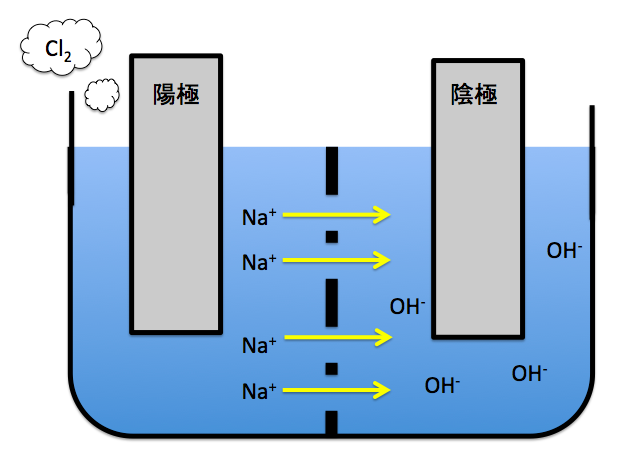
そして、このように陽極側から陰極側にNa+が移動していきます。陽イオン交換膜は、陽イオンのみを移動させることができます。
すると、陰極にNaOHが出来上がります!このようにNaOHが生成されていきます。
全体まとめた式
電気分解は、普通に酸化還元反応なので、電子を消すという方向性で化学反応式を作っていけば良いと思います。
2NaCl+2H2O→2NaOH+Cl2+H2
となります。
陽イオン交換膜とは?

陽イオン交換膜とは、このように陽イオンだけが通れる膜のことです。

このように陽イオン交換膜は、表面に-SO3–がついている状態です。なので、陰イオンは電気的にーとーなので反発する力が生じます。

なので、陰イオンは、このようにはじかれます。
しかし陽イオンは、

このように通れます。ー+ーだから陽イオンは出られなくなるのでは?と思うかもしれませんが、Na+はどんどん生成されていくので、
どんどんおしだされていきます。
なのでどんどん陰極側に押し出されていきます。
陽イオン交換膜を使う理由
OH–が陽極に流れ込むのを防ぐ
この陽イオン交換膜はOH–が陽極に流れ込んでしまうのを防ぐためが1つです。
というのも、陽極はCl2が発生します。このCl2は水に溶けて、酸性物質の塩化水素と次亜塩素酸が出来上がります。
Cl2+H2O→HCl+HClO
ここにOH–が入り込んでしまうと、中和反応が起ってしまい、せっかくのOH–が消費されてしまいます。
これはもったいないので陽イオン交換膜を使います。
Cl–が陰極へ流れ込むのを防ぐ
また、もう1つは、陽極からCl–が陰極に流れ込んで、不純物となります。純粋なNaOHが取り出せなくなります。
なのでこれを防ぐためにも陽イオン交換膜を使います。
いかがでしょうか?
陽イオン交換膜の知識がわかれば、あとはただの電気分解の問題なので、無理やり反応式を覚えようとするのはヤメておきましょう!
水酸化ナトリウムを生成するための工業的製法をご紹介しました。工業的製法は陽イオン交換膜法以外にも多数あります。大学受験でも非常によく出るトピックですので、頭の整理をしていきましょう。
こちらからご覧ください。















コメントを残す