酸塩基・イオン・中和・電気分解 etc…
複数の単元に出てくる「水酸化ナトリウム」は、化学の世界のマルチ・プレーヤーです。
実験で扱った経験がある人も多いのではないでしょうか?
今日は知っているようで知らない「水酸化ナトリウム」の性質を徹底的に解説します!
水酸化ナトリウム以外の「アルカリ金属水酸化物」の性質を知りたい人は、この記事を読んでみてください!
目次
水酸化ナトリウムの性質
一般的性質
常温では「白色の固体」です。
特徴的な匂い等はありません。
フレーク状にしたものが、実験室ではよく用いられます。

組成式
水酸化ナトリウムの組成式は
NaOH
です。
これは「分子式」ではなく、イオン結晶を表す「組成式」です。
CO2やH2Oのように分子として存在しているのではなく、ナトリウムイオン(Na+)と水酸化物イオン(OH–)が1:1の割合でイオン結合しています。
化学結合についてもっと詳しく知りたい人は、この記事も読んでみてください。
式量・モル質量
ナトリウム(Na)・酸素(O)・水素(H)の原子量はそれぞれ23・16・1です。
したがって水酸化ナトリウム(NaOH)の式量は23+16+1=40です。
モル質量は40 g/mol になります。
イオン結晶なので「分子量」ではなく、「式量」を用います。
沸点・融点
イオン結合は「強い結合」であるため、イオン結晶の融点・沸点は一般的に高くなります。
水酸化ナトリウムの融点は318℃、沸点は1388℃です。
溶解度(潮解性)
水への溶解度は非常に大きく、20℃で1110 g/l です。
1kgの水に1kg以上の水酸化ナトリウムが溶ける計算になりますね!
水に非常に溶けやすいので、なんと空気中の水分を吸い取って溶けます!
これは潮解性という性質です。
ビンのフタをしっかり閉めずに放置すると、ビッチャビチャになるので注意です!

電離式
水酸化ナトリウムは水に溶けると電離し、ナトリウムイオンと水酸化物イオンに分かれます。
NaOH → Na+ + OH–
水溶液の液性
水酸化ナトリウム水溶液は水酸化物イオン(OH–)を含んでいるので塩基性(アルカリ性)になります。
さらに水酸化ナトリウムの電離度は「1」、つまり100%電離するので強塩基です。
pH
1mol =40g の水酸化ナトリウムが1リットルの水に溶けている場合を想定しましょう。
この溶液のモル濃度は1mol/l ・電離度は1なので、pHは
[H+] × [OH-] = 1.0 × 10-14
[H+] × 1.0 = 1.0 × 10-14
[H+] = 1.0 × 10–14
pH = 14
になります。
これより濃度が高い場合はpHが大きくなり、濃度が低い場合はpHが小さくなります。
たとえば、0.1 mol =4g の水酸化ナトリウムが1リットルの水に溶けている場合のpHは
[H+] × [OH-] = 1.0 × 10-14
[H+] × 0.1 = 1.0 × 10-14
[H+] = 1.0 × 10–13
pH = 13
になります。
塩基性溶液のpHの求め方を詳しく知りたい人は、この記事を参考にしてみてください。
危険性
強い塩基性を持つ水酸化ナトリウムは皮膚や眼球の主成分であるタンパク質を溶かすので、取り扱う時は必ず安全メガネと手袋を装着しましょう!
また水酸化ナトリウムは大きな溶解熱(45kJ/mol)を持ち、水に溶けるときかなり発熱します。
したがって水溶液を調整する時は、まず水に水酸化ナトリウムを溶かし、その後で目的の体積になるまで水を加えます。
固体の水酸化ナトリウムに水を加え調整すると、発生した溶解熱により水が沸騰して溶液が飛び散り大変危険です!

別名
ナトリウムの別名は「ソーダ」です。
ナトリウム化合物の中でも、水酸化ナトリウムは皮膚などを侵食する力が特に強いので「苛性ソーダ」とも呼ばれます。
また「ナトリウム」はドイツ語です。
英語では「ソディウム」といいます。
したがって水酸化ナトリウムは英語で「ソディウム・ハイドロキサイド(Sodium Hydroxide)」になります。
水酸化ナトリウムの製法
水酸化ナトリウムは意外に簡単な方法で作ることができます。
それは「食塩水の電気分解」です!
「え!? それだけ??」と思うかもしれませんが…
それだけです!!
食塩水にはナトリウムイオン(Na+)、塩化物イオン(Cl–)、水素イオン(H+)、水酸化物イオン(OH–)の4種類のイオンが含まれていますよね。

この溶液に電極を入れ、電圧を加えます。
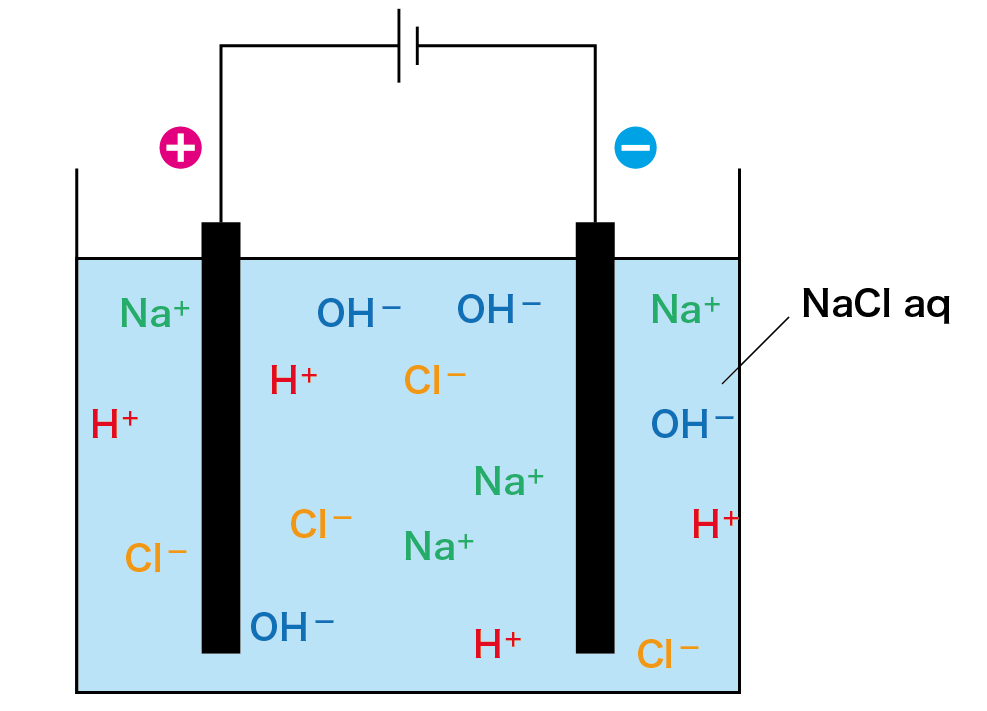
すると陽極では「塩素ガス」が、陰極では「水素ガス」が発生します。
その結果、水溶液中からどんどん塩化物イオン(Cl–)と水素イオン(H+)がなくなっていき、最終的に水酸化ナトリウム水溶液になるのです!

ね! できたでしょ!
しかし、この方法は純粋な水酸化ナトリウムを大量に作ることには向いていません。
電気分解を塩化物イオンがなくなるまで続けるのは難しいですし、発生した塩素ガスも水溶液中に溶け込んでしまいます。
そのため工業的には「イオン交換膜法」という、この電気分解を応用した方法が用いられます。
イオン交換膜法については、この記事で詳しく解説しています!
水酸化ナトリウムの利用
受験によく出る水酸化ナトリウムの使用方法は「気体の乾燥剤」です。
発生させた気体に含まれる水分を取り除くために、水酸化ナトリウムの「潮解性=空気中の水分を吸収する性質」が使われます。
水酸化ナトリウム中を気体が通ると、その中に含まれる水分が取り除かれ乾燥するのですね!

でも潮解して液体の水が生じてしまうと、水に溶けやすい気体はその水の中に溶け込んでしまいます。
これを防ぐため、水酸化ナトリウムは酸化カルシウムと混合させた「ソーダ石灰」として乾燥剤に用いられます。
水酸化ナトリウムが吸収した液体の水を、酸化カルシウムに吸わせるのですね。
CaO + H2O → Ca(OH)2
ソーダ石灰について詳しく知りたい人は、この記事も読んでみてください!
しかし、この方法には注意すべきがあります。
水酸化ナトリウムが乾燥に使えるのはアンモニアなどの「塩基性か中性の気体」だけなのです。
水酸化ナトリウムは塩基性乾燥剤なので、塩化水素(HCl)や二酸化炭素(CO2)のような酸性の気体を通過させると反応してしまいます。
水酸化ナトリウムは安価に製造でき、強い塩基性を持つので「アルカリ剤」としても様々な用途に使われています。
浄水場でpHを調整するために使われたり、髪の毛のタンパク質を溶かすのでパイプのつまりを溶かす洗剤としても用いられます。

水酸化ナトリウムは油脂を「けん化」するので、石けんの製造にも使われます。

変わった使い方としては、人毛から醤油をつくるために用いるそうです。
人毛を塩酸で溶かし、水酸化ナトリウムで中和すると醤油のような「アミノ酸が豊富な液体」になるそうです。
とても危険なものができる感じがしますね!
でも、塩酸と水酸化ナトリウムが完全に反応するとただの食塩水になるのです。
HCl + NaOH → NaCl + H2O
戦後の物資不足の時に、製造が検討されたけれど結局実用化はされなかったとか。
でも実用化されなくてよかったですね。
髪の毛から作られた醤油なんて、もし美味しくても使いたくないですよね!
まとめ
この記事では水酸化ナトリウムの性質を徹底解説しました。
水酸化ナトリウムの主な特徴は
・水に溶けると強塩基性を示す
・溶解度が高く潮解性がある
・食塩水の電気分解で生成する
です!