こんにちは。


こんな疑問を解決していきます。
系統分析はワンパターンです。というのも、作業手順を変えるとうまく陽イオンを分離することができなくなるからです。
なので、系統分析は別にフリー素材をすることができるとしたら
ということで、今回は陽イオンの系統分析を実践的に解いていく方法までお話ししていこうと思います。
目次
陽イオンの系統分析とは?
溶解度の差を使って陽イオンをグループごとにバラバラに析出させる方法
最終的には陽イオンを個別にバラバラに分けて析出させたい

溶液の中にいっぱい陽イオンがあった時に、個別で取り出すのって難しいですよね。こんな風に陽イオンって目に見えませんからね。
だから名前の通り系統分析とは陽イオンを系統(グループ)に分けて析出させる方法です。
まずはざっくりグループ分けしてみて、陽イオンを絞り、絞り込んだ中で陽イオンを個別に分析していくことが目的なのです。
最終目的はごちゃ混ぜに陽イオンが入っている溶液から、陽イオンをバラバラにすることです。
でも、いきなりバラバラにすることはできません。なので、溶解度の差を使ってグループ(系統)に分けて析出させます。
陽イオンの系統分析の全体像
- 沈殿させて6つのグループ(系統)わけをしていく
- 沈殿を再溶解させてそれぞれグループ内で分析する
- イオンの色で個別陽イオンを決定していく
まずざっくり系統分析ってこういうものだってのを3段階に分けます。系統分析の原理原則はこの3手順です。
1.沈殿させて6つのグループ(系統)わけをしていく
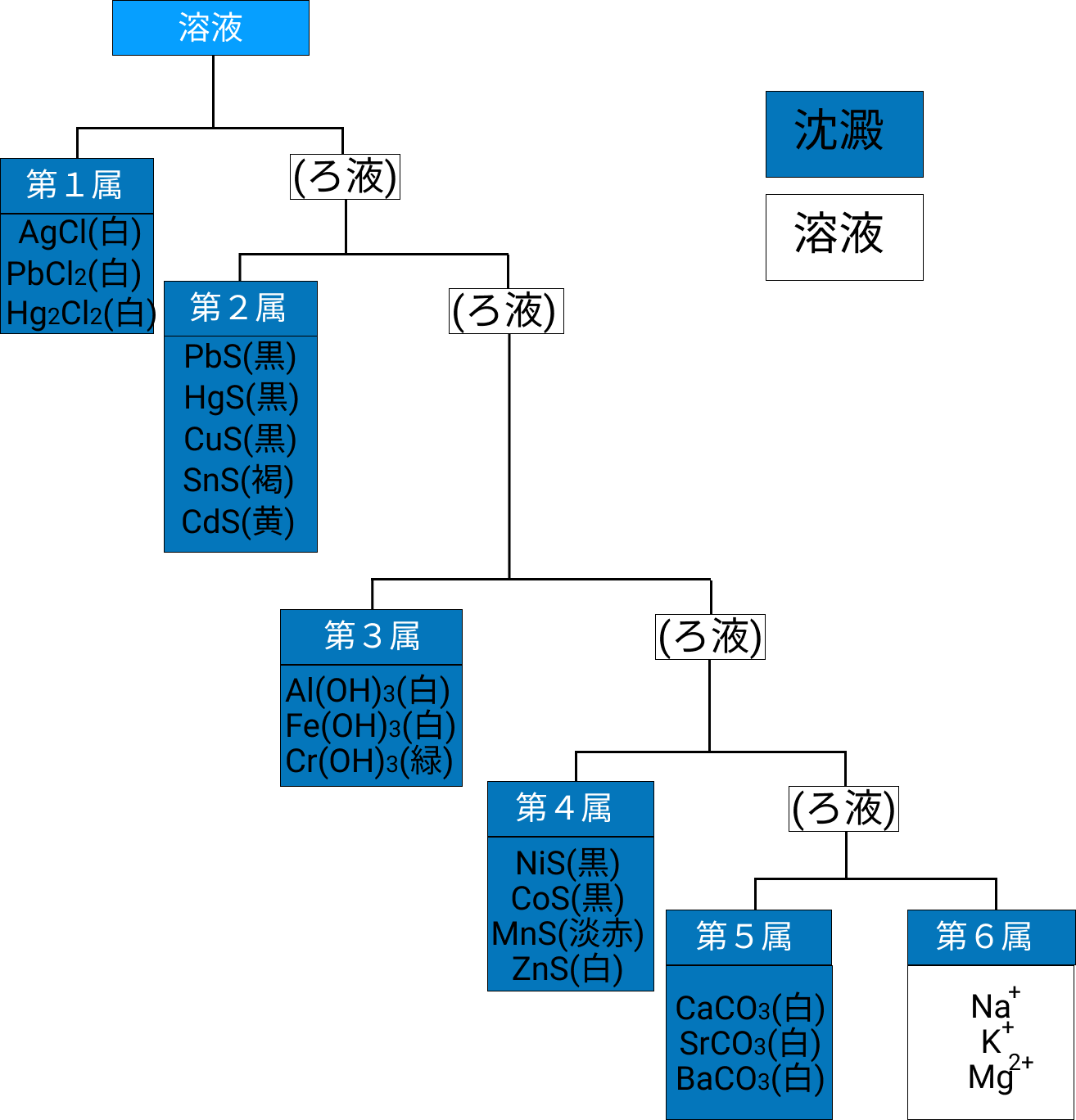
このようにまずは溶解度が小さい陽イオン順(沈殿しやすい順番)にどんどん沈殿させていくのです。
この溶解度の差を大きく分けて6つのグループに分けていきます。これを分属と言います。
割と溶解度とイオン化傾向は密接に関わっています。当然ですが、イオン化しやすいってことは水に溶けやすいですからね。
そもそもイオンって水に溶けやすいです。水に溶けるって現象は結合に+とーの差がある時に起きることです。
イオンで沈殿するってことはそれくらいイオンと
参考記事:イオン結晶なのに水に溶けないやつは?
なので、ここで絶対に必要な知識がどんな陰イオンと沈殿をするかの情報です。これを頭に入れておかないと絶対に系統分析を解くことはできません。
ちなみに、この中で重要なのはH2Sです。硫化水素の酸性条件でも沈殿するほど
このように1グループずつ沈殿をさせていくのです。当然最後に残るのはイオン化傾向が非常に大きいアルカリ金属などが残っていきます。
時々

と聞かれることがあります。これは大学3年生くらいにならないと無理です。色は理屈をつけて暗記から逃れることはできません。
2.沈殿を再溶解させてそれぞれグループ内で系統分析する

1で分属(グループに分ける)をしましたね。そのグループごとに系統分析をします。
先ほどの沈殿を取り出して、再溶解(沈殿をもう一度溶解させること)したりして再び系統分析をします。
それぞれのグループごとの系統分析はこの記事の後半で解説しています。
3.主に色を使って陽イオンを決定する

2で分離したもので系統分析できたら最終的に何が残ったかを検出し、陽イオンを決定していきます。
- 再溶解した錯イオンの色
- 沈殿の色
- 炎色反応
などを使って検出し陽イオンを1つずつ単離していきます。
かなり視覚的な指標が多いですが、匂いを嗅いだり、触れたりするのは非常に危険だからです。中和滴定や酸化還元滴定でも色で終点が判断できるものが多いですよね。
その理由は視覚的にわかることが一番安全だからです。
系統分析の属(グループ)分けの基準はH2S

系統分析は6つにグループ分けしますが、実は大きく分けると3つにグループが分かれているんです。その3つのグループは、「H2S」とイオン結晶をいかに作るかで分かれています。
よく見かける系統分析のチャート図をみてもらいましょう。

このチャート図をみると、H2S(硫化水素)のみ2回出てきてますよね。実は、これがポイントなんですよ。
この硫化水素で3グループに分けられます。そのグループが
- 酸性条件でも硫化水素と沈殿する陽イオン
- 塩基性条件なら硫化水素と沈殿する陽イオン
- どんな条件でも沈殿しない陽イオン
この3グループです。

この属は実は、イオン化傾向によって分けられています。
徐々にイオン化傾向が小さいものから沈殿させて削られているのでした。
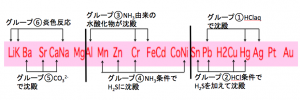
このように分けます。
陽イオンを6属に分属する

6つのグループに分属していきます。方法は先ほど言った通りに沈殿しやすいやつらから次々に落としていきます。
そして、沈殿しやすいやつらとはイオン化列の右の方です。溶けていたくない陽イオンがどんどん沈殿していくのです。
第1グループ 希HClで沈殿させる

まずHClで溶液からイオン化傾向の小さいものを沈殿させていきます。
第1グループは最も沈殿しやすいグループです。よく考えて欲しいんですが、HClで沈殿するってよっぽどのことじゃないですか?
つまりHClで沈殿する金属は金属の中でよっぽど電気陰性度が大きい(金属の割には電子が好き)ってことです。
参考記事:共有結合,イオン結合,金属結合の違いは?高校化学の嘘を暴露
Cl–で沈殿するのは、
で覚えます。
第2グループ 残存しているHCl条件で、H2Sで沈殿するもの

次は硫化水素です。
HCl条件、つまり酸性条件でH2Sを加えて沈殿するグループです。
Cl–を加えても落とせなかった残りのイオン化傾向の小さい奴らを沈殿させる作戦です。
第3グループ NH3由来の弱塩基条件で水酸化物として沈殿するもの

沈殿生成反応でOH–で沈殿するものが合ったと思いますが、そのグループです。
これはイオン化傾向でいうと、真ん中らへんの族です。
NH3+H2O⇄NH4++OH–
の反応が起る事によりできるOH–によって沈殿が生成します。
ここで沈殿するんは、アルカリ金属、アルカリ土類金属のLi K Ba Sr Ca Na Mg以外が沈殿します。
Mgは塩基性条件で沈殿します。
第4グループ NH3由来の弱塩基条件でH2Sを吹き込み沈殿するもの

H2Sには液性関係なく沈殿するものと中性塩基性でないと沈殿できないものがありました。
そして、液性に関係なく沈殿するものが第2属でした。
第5グループ SO42-、CO32-で沈殿するもの

炭酸イオンを加える事で沈殿が生じるものがあります。
SO42-CO32-
Ba2+ Ca2+ Sr2+ Pb2+
これをあわせて、
そこまでばかにするな
と覚えるのでした。
これで沈殿する金属を第5属とします。
第6グループ:残り物

最後に残ったグループが第6グループです。
どうやっても沈殿しないものたちが集まった陽イオンです。ちなみに、こいつらを析出したければ電気分解をするしかないです。
6つのグループごとの系統分析の手法
さて、6つのグループに分属しましたが、ここからはグループごとに系統分析をしていきます。
系統分析はそれほど難しくないと言う理由は、沈殿反応が決まっているため、流れが決まっていると言う事です。
なぜなら、せっかく取り出せて来たところに、強塩基やから、強酸やらを加えてしまうと、全て溶けてしまったりと、水の泡になってしまう可能性があります。
なので、この系統分析は、『手順』がある程度決まっています。そして先ほどのグループ分けの順番が手順です。
先ほどのようにグループ分けをして沈殿させて、その後に、沈殿した者を再溶解させてグループ内で系統分析をします。
グループ1の系統分析

グループ1のAg,Pb,Hgをバラバラに系統分析していきます
ステップ1:熱湯を注ぐ

まずこの分離操作の1つ目の手順として熱湯を加えます。するとPbCl2だけイオンに戻ります。一方で、AgClとHg2Cl2は沈殿のままです。
これでまた、溶液と沈殿を分離する事で、Pbを取り出す事が出来ました。
ただし、熱湯を注いでPb2+を取り出せた気になっているだけです。なので、きっちりPbが溶けていることを「色で」確認する必要があります。
ステップ2:K2CrO4を加える
クロム酸カリウムを入れることでPb2+はCrO42-とイオン結晶を作り沈殿します。
クロム酸鉛(PbCrO4)が黄色の沈殿であることから、先ほど熱湯を注いで再溶解したのはPb2+だったことが確認できます。
さあ残りは溶液には、AgとHgのみとなります。
ステップ3:NH3水を加えまくる
こいつらは依然AgClとHg2Cl2です。これをどちらかは沈殿のまま、どちらかを錯イオンとして溶液中へ分けると言う作業をします。
沈殿に対してアンモニア水を加えると溶解します。
大量のおしっこで喘いだあげくどうせ逃げてシス
大量のNH3 Zn Ag Cu Ni
でした。なので、これからAgClが錯イオンとして再溶解します。
これによって分離できます。Agはこのあともう一度HClを加えれば、AgClで沈殿になってくれます。
グループ2の系統分析

ステップ1:沈殿の色が黄色の時点でCdSに決定
硫化物イオンとの沈殿でCdSのみ黄色です。この時点で、決定です。
ステップ2:HNO3を加えて熱する
硝酸を加えます。硝酸は酸化剤として反応することは半反応式のところでもお伝えしました。
この時HgSは溶解度が小さいので

という疑問が湧くかもしれませんね。これは、金属イオンが酸化される訳ではなくS2-が酸化されてSになるんです。これのせいで、Cu2+とPb2+がイオンとして溶解するんです。
残ったのはCu2+とPb2+です。なので、これらを分けていきます。
ステップ3:H2SO4を加える

最後にH2SO4を加えると、SO42-と沈殿をするPbがPbSO4が白色沈殿をします。残った溶液にCu2+が存在します。
そ(SO42-)こ(CO32-)までば(Ba2+)か(Ca2+)な(Pb2+)
ですから、PbSO4が白色沈殿して、その他のCu2+はそのまま溶液中に存在します。あとは、残った溶液がCu2+のみだということがわかればOKです。
「あれ、なんで1属じゃなくて2属に鉛がいるの?」と思ったかもしれません。
PbCl2はやや水に溶けやすいので第1属にあるのは不完全なのです。なので、残ったPb2+はPbSとして2属でも沈殿します。
ステップ4:残りの溶液にアンモニア水を加える
アンモニア水を加えるとCuは錯イオンを作ります。
[Cu(NH3)4]2+の深青色の溶液になります。NH3水を入れて[Cu(NH3)4]2+の深青色が確認できたことからアンモニア水だったことがわかります。グループ3の系統分析

ステップ1:NaOHを加える
すでに水酸化物の沈殿にさらにNaOHを加えると再溶解する
彼女はナオコ苦労せずああすんなり再溶解
過剰なNaOH Cr Zn Al Sn Pb
なので、Fe(OH)3だけは沈殿のままで、それ以外のAlとCrは再溶解して錯イオンになります。
また、沈殿のFe(OH)3には赤褐色の色があります。色付きで他に同じ色の沈殿もありえないのでFe(OH)3は決定できます。
ステップ2:H2O2を加え熱する
先ほどNaOHを加えたことで塩基性になってますよね。これにさらにH2O2を加えることで[Cr(OH)4]–がCrO42-に酸化されます。
ステップ3:希塩酸とアンモニア水を加える
希塩酸を加えることで、AlCl3とすることができます。
また、溶液中のOH–を減らすことができます。
そのためには、もう一度Alを普通のAl3+イオンに戻しておく必要があります。
グループ4の系統分析

ステップ1:加熱後HClを加える
加熱後HClを加えることで、NiSは結晶形が変化して希塩酸に不溶になります。よってNiSだけが沈殿のまま残りZnは溶解します。
ステップ2:塩基性でH2S
塩基性でH2Sを加えていきます。ZnSの白色沈殿ができます。
グループ5、6の系統分析
グループ5、6の金属は基本的に炎色反応で陽イオンを決定していきます。
陽イオンの系統分析で記述で狙われる「操作の理由」だけをまとめてみた
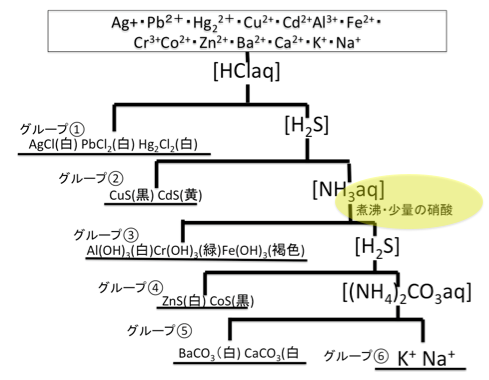
この操作の理由を問われる事があります。ちなみに画像をつくるスペース的に[NH3]より下になりましたが、
煮沸する、少量の硝酸を加えるその理由が問われる事があります。
煮沸する理由

この操作はアンモニアを加える前にやります。
なぜなら、H2SやHClなどが残っていると、中和されてアンモニアの塩基性になりにくいです。邪魔です。
なので、HClやH2Sを吹き飛ばすために煮沸します。
少量の硝酸を加える

硝酸というのは、酸化力がありましたね。
この酸化力をもちいてFe2+をFe3+に酸化します。
というのも、H2Sは還元性があるため、Fe3+をFe2+に還元してしまうのです。
なぜFe2+になると良くないかと言うと、Fe2+はアンモニアとの反応で、[Fe(NH3)6]を形成してしまうので、

NH3を加えたときにOHとの沈殿が起らないのです。これより、鉄は3価にしておく方が良いのです。
最後に
- 沈殿させて6つのグループ(系統)わけをしていく
- 沈殿を再溶解させてそれぞれグループ内で分析する
- イオンの色で個別陽イオンを決定していく
陽イオン系統分析は沈殿問題の総合的な問題です。
ただし、陽イオンの沈殿するパターンが決まっているし、手順も決まっていて非常に解きやすい問題です。ここは確実に得点したいところです。
また、この流れを全て順番に覚える必要もなくて、問題に合わせて考えれば普通に解けますので、解いてください。














こんばんは。
よく分からなかったのでしつもんさせてください。ピンク色のイオン化傾向の表にある黒の縦線の仕切りはどういう意味があるのですか?
仕切りできっちり②グループずつあることがわかります。特に意味は無いですが、
HgSが王水に溶けるとかいうのは覚えないとダメですか。
そうだとしたらなんでHgOになるか教えていただけますか。
溶液Fe³,Al³,Zn²,Ca²,Na(+は省略)にNH3を加えたときAl³が錯イオンにならず、Al(OH)3となって沈殿する理由を教えていただきたいです。
すみません。自己解決しました。
失礼しました。
質問です。
最後の3属の分離で、AlとCrを分離する最初の段階で酸化剤を加えていますが、「NaOH」条件なのは何故でしょうか?
塩基性条件だと酸化剤H2O2によってCrO42-まで酸化されます。
一番最初の図の第六属って、あれで合ってるんです?第四属とまるっきり同じなんですが…
いや、間違ってます。。。。
ありがとうございます。
悔しいい・・・・・直すの面倒臭い・・・・・
炭酸アンモニウムを加える前に酢酸酸性にして煮沸するのはなぜですか。
参考書によって煮沸をしていないものや、塩酸酸性で煮沸しているものがあり混乱しています。
Fe(OH)3は赤褐色ですよね
そのように書いていますが、どこの指摘してます?