ダイヤモンド型結晶の問題は意外と扱い方をわかっていない人が多いです。
というのも、面心立方格子だったり、体心立方格子だったり、他の単位格子よりも繰り返し単位がわかりにくくなっているからです。
そこで、今回は、ダイヤモンド構造に徐々に慣れていき、そしてダイヤモンド構造の問題を解けるようにしていきましょう!
目次
ダイヤモンド型構造の結晶とは?
なぜダイヤモンド型構造を苦手に思う人が多いのかというと、
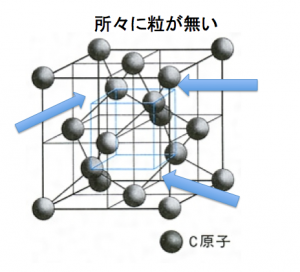
引用:コトバンク
今までの体心立方格子や面心立方格子よりも規則性が難しいのです。
だから、ダイヤモンド構造は難しいと思われがちです。
また、ダイヤモンド構造の画像が2パターンくらいあって、どのように見れば良いのか?というのがわかりにくいのです。

引用:http://bb.phys.se.tmu.ac.jp/~bb/pukiwiki/index.php?Neutron_xray_2%2FC
これもダイヤモンド構造である。ということが受け入れられない人も多いです。
この辺りの立体的な物がとらえられない人が多く居ます。なので、ここら辺をきっちり意識していきましょう!
まず、ダイヤモンド型構造は、単位格子の1辺1辺の中点を結んでいくと、8分割出来ます。

これを、
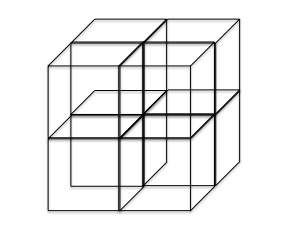
8分割してこの8つの部屋に1つおきで原子を放り込んでいきます。
また、8分割されたとこを見てみると、このように下のようになります。
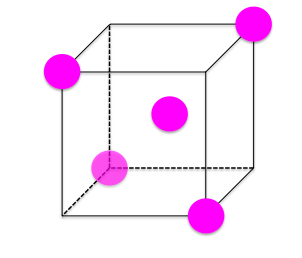
この部分を見ると、正四面体構造を表します。

この正四面体構造はこの後非常に重要になってきます!
それではまず、具体的にダイヤモンド型構造の物質の例を見ていきましょう!
ダイヤモンド型構造の例
基本的にダイヤモンド型構造になるのは、14族元素が共有結合結晶をしている場合がほとんどです。
14族の元素は、価電子が4個あり、
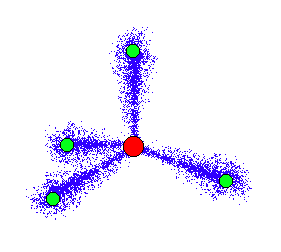
引用:http://www.geocities.ws/yoshihitoshigihara/elec4.htm
このように、原子がそれぞれ正四面体構造を示します。(※これをsp3混成軌道と言ったりしますが、大学で学んでください)
ダイヤモンド

ダイヤモンド型なんですからそりゃあもちろんダイヤモンドもダイヤモンド型結晶です。
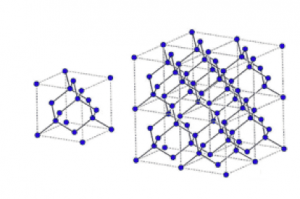
引用:https://www.jsps.go.jp/j-grantsinaid/31_result/rikou/img/20_sunada_b.gif
このように、左が単位格子で、右がそれがどんどん組み合わさっていく様子です。
氷
氷も結晶化するとダイヤモンド型になります。

このようにOの周りに4方向の結合があります。しかし、このOのまわりの4本の手は、実態は正四面体方向に伸びているのです。
それを無理やり平面にならべたものをフィッシャー投影式と言います。
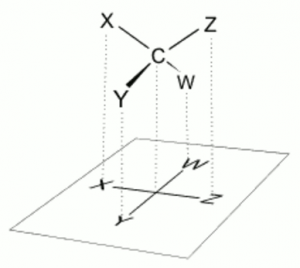
つまり、水のOは本当は、正四面体方向に手が伸びているのです。
普通、物質の三態で体積は、気体>液体>固体となりますよね。
しかし、なぜか水だけは、気体>固体>液体で、固体が液体より体積が大きくなるのです。
水を凍らせるとなぜか盛り上がるのです

↓

引用:http://hiro55913.blog45.fc2.com/blog-entry-476.html
このようになります。
水以外の物質は分子間でファンデルワールス力のみがはたらきます。

しかし、水の場合は、H-O-Hが沢山分子があれば、H-O-HのOと別の分子のH-O-HのOとHが水素結合します。

この緑の線が水素結合を表します。この水素結合でくっついているHとOの結合を含めてダイヤモンド型構造になっているのです。
これが氷の最も最適な状態なのです。そして、ご覧の通り、『ダイヤモンド型構造』というのは中に空洞がありますよね。
つまり、空洞の中に水分子が入れば体積が小さくなるのです。もしこの氷を溶かして水に戻すとこの空洞の中に水分子が入り込んでいきます。
だから、液体の方が固体より体積が小さくなります!
SiやSiO2など

出典:https://www.quora.com/How-can-I-calculate-the-ratio-of-Si-to-O-atoms-in-SiO2-or-the-empirical-formula-of-it-based-on-its-structure
Oがなければ、Siだし、OがあればSiO2です。これもきっちりダイヤモンド型構造ですね!
共有結合の結晶の物は結構ダイヤモンド型構造が多いです!
ZnS(硫化亜鉛)

出典wikipedia
このように硫化亜鉛はイオン結晶でありながら、ダイヤモンド型構造を取ります。
ダイヤモンド型構造はどんな問題がでるのか?
まあこれは、ダイヤモンドに限らず結晶構造系の問題はだいたいこいつらがでます。
『単位格子内の原子の個数』『密度』『原子間距離』『充填率』
です。
単位格子内の原子の個数
ダイヤモンド構造の単位格子内の原子の個数は
まず角に1/8が8箇所ありますので、角だけで1個
面心にも1/2個があり、6面にありますので、3個
そして、4個まるまるありますので、4個
合計で単位格子内には、8個の原子があります。
密度
密度は、単位に着目すれば余裕でわかります。密度と言うのは、

ですので、これを分子と分母にわけて求めれば良いです。
まず、分子のgを求めたいですが、gがそのまま与えられる事は無いので、gが含まれている単位である、モル質量(g/mol)を用います。
molが邪魔なので、molを消しますが、molは与えられていないので、molが含まれているアボガドロ定数の逆数で掛けると次のような単位になります。
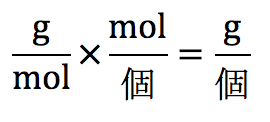
g/個になりますので、個を掛ければgになります。

モル質量をM,アボガドロ定数をNA,ダイヤモンド型構造の単位格子内の個数は8個となりますので、

そして分母は、単位格子の一辺の長さの3乗が体積ですので、

原子間距離と単位格子の関係
この原子間距離は非常に重要です。充填率を求めるときにも非常に重要になってきます。
まず、ダイヤモンド型構造の場合、ほとんどの場合『原子半径』は与えられません。
なので、『単位格子の1辺の長さ』から原子半径を求めていけば良いです。
これについて動画でまとめました。
充填率
充填率とは何か?について詳しく知りたい方はコチラの記事からご覧下さい。
まとめ
ダイヤモンドの結晶構造は結晶の分野でもなかなか出やすい分野です。
でも、結晶の分野はもはや聞かれる事はほとんど決まっていますので、恐れるに足らず!
ダイヤモンドと黒鉛は同素体で、結構性質も違いますのでこれも整理しといた方が良いですよね!
ダイヤモンドと黒鉛の違いの記述はこの2つを外すな!
で確認しよう!

















コメントを残す