ダイヤモンドと黒鉛の違いは記述問題によく出ます。
ダイヤモンドと黒鉛は炭素の同素体です。
そして、ダイヤモンドも黒鉛もどちらも共有結合の結晶です。
でも、ダイヤモンドと黒鉛では全く性質がちゃいます。
だから、今日はその理由を解説していきます!
目次
ダイヤモンドと黒鉛の違いが現れる2大性質
ダイヤモンドと黒鉛の違いというのは、記述問題で頻出です。そして、この2つの違いは以下の2つの事に着目して記述すれば確実に満点が取れる!
強度と固さ
ダイヤモンドはご存知クソ固いです。でもご黒鉛はめちゃめちゃ柔らかくはがれやすい。このはがれやすさを利用して鉛筆やシャー芯になっている。

まずこの違いを話さなければならないです。これはダイヤモンドと黒鉛の構造の違いから考えていきましょう。
ダイヤモンド
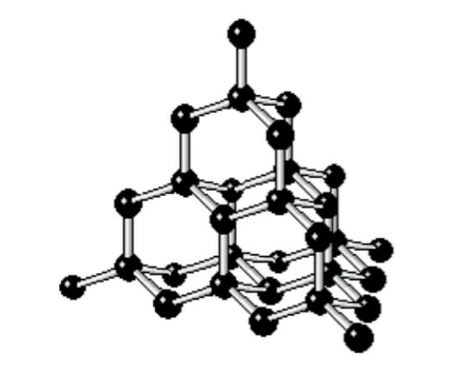
引用:http://bb.phys.se.tmu.ac.jp/~bb/pukiwiki/index.php?Neutron_xray_2%2FC
このようにダイヤモンドは全ての炭素原子の全ての結合が共有結合なのです。
これは、ダイヤモンドの1つ1つの炭素原子が正四面体構造だからとも言えます。

黒鉛
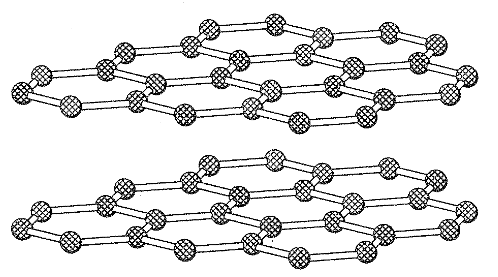
実は、黒鉛はこのように網目状の構造を『平面』にとる。
この平面ってことがミソなんです。
なんで平面になるのかって言うと、炭素原子がこのように、
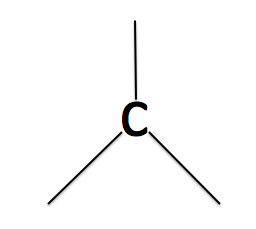
手が3本になっていてこの平面構造なのです。この3本の手の結合が繋がると平面構造になって、いきます。

そして、黒鉛はこの平面構造が重なり合ってくっついて出来たものなのです。

そして、この層と層の間の結合は、ファンデルワールス力なのです。
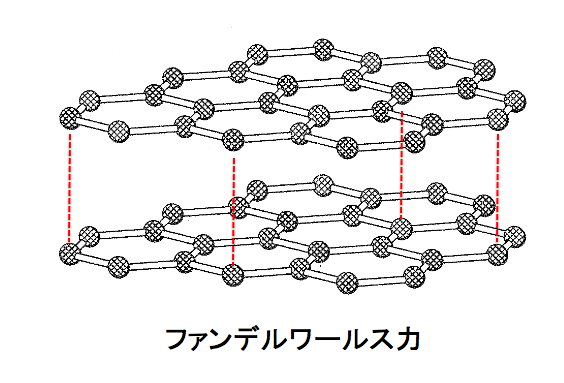
鉛筆で文字が書けるのは、ファンデルワールス力が鉛筆の芯と紙との摩擦で簡単に切れて、層が紙に落ちてへばりついているからです。
じゃあなんで、こういう風に炭素が正四面体になるのか平面構造なるのか?その理由が知りたい!と言う人は早く大学に合格してください。
これは混成軌道の話で、sp3混成軌道とsp2混成軌道の話が絡んできます。高校レベルでちゃんと理解する事は不可能です。
でも電子式から構造を推測する事は出来ます。
『電子式から構造を推測する方法はこちら』
電気伝導性
ダイヤモンドは電気を通しません。ですが黒鉛は金属でも無いのに電気を通します。
ダイヤモンドは、先ほど言ったように炭素の4本の結合手を全て使って、共有結合をしまくっていますよね?
でも、黒鉛を見てください。先ほど言ったように、

3本で結合しています。でも炭素の価電子は4個です。
そう、電子が1個余っているため、その電子がまるで自由電子のように振る舞うのです。
この自由電子のように振る舞う電子のおかげで、黒鉛は電気伝導性があるように見えるのです。
「ダイヤモンドと黒鉛の違いを説明せよ」を文章かしてみよう!
この「ダイヤモンドと黒鉛の違いを説明せよ!」という問題は、

というようなテキトウなお願いの仕方もあれば、

またここに文字数という縛りプレイもある。どんな事があっても絶対に外してはいけないポイントはこの記事で説明して来た2つのポイントです。
自由記述の場合の一例を載せておきます。これは別に覚える必要は無いし自分で上の2つの内容をまとめられれば、それが正解です。
ダイヤモンドと黒鉛の違いは、固さと電気伝導性である。ダイヤモンドは全ての炭素原子が共有結合で立体的な網目状構造を作るため固くて丈夫であるが、黒鉛は炭素原子が平面の網目状の層構造を作り、層同士は弱いファンデルワールス力で結合しているため柔らかくてもろい。またダイヤモンドは4個の価電子が結合に使われているため電気は流れないが、黒鉛は結合に3個しか価電子が使われておらず、余っている1個の価電子が層上を自由電子のように移動し、電気が流れる。
こんな感じにまとめれば良いです。文字数や問われ方でまた色々変わります!
まとめ
ダイヤモンドと黒鉛の違いは、『堅さ』『電気伝導性』です。
黒鉛がもろいのは層状で層同士が、一番弱い結合ファンデルワールス力で繋がっているから。
黒鉛が電気を通すのは、黒鉛は結合に価電子を3個しか使っていないから1個余っているからです。
キッチリ整理して自分の言葉で記述問題を解けるようにしておいてください!
それでは!
















めちゃめちゃわかりやすかったです。
これって鉛筆の色が濃い方が和やらかく、薄い方が硬いということと繋がりがあるんですか?
ありがとうございます!
めっちゃ鋭い質問ですね!
まあ実際、そこまでミクロなレベルでのコントロールは難しく、様々な樹脂や黒鉛の割合で決まっています。
黒鉛も、平面の方向であればダイヤモンド並みに硬いのですか?
そうです!