こんにちは。
化学の基本法則で、「定比例の法則」と「倍数比例の法則」があります。この2つって名前も似ているし、法則の内容もかなり似ていますよね。
だから、この2つを区別がなかなかつきません。しかもこの2つの法則って区別できないと解けない問題も出てきたりします。なので、今回は演習問題もつけて区別できるようにしました。
必ず最後まで読んでみてください。
目次
定比例の法則と倍数比例の法則の違いは?
定比例の法則は、

木を燃やしてできる二酸化炭素も、人間の呼吸で生み出される二酸化炭素も、炭素元素と酸素元素の質量比は同じですよ〜ってことを表しています。
倍数比例の法則は、原子の存在を強めるために提唱された法則です。
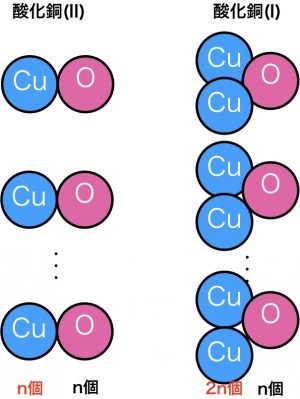
このように酸素が同じ質量なら、
今なら、CuOとCu2Oって化学式で表せるのだから、Cu(II):Cu(I)=1:2であることは明白ですが、当時は画期的でした。これのおかげで原子の存在を信じる人が増えました。
さて、この2つどう違うのか?
実際入試問題では、この2つを区別する必要がある問題が出ることがあります。この2つの区別の仕方は簡単です。それは、
1種類の化合物の成分元素の質量比を表すのが定比例の法則
2種類以上の化合物の成分元素を比較しているのが倍数比例の法則
定数比例の法則は、CuOならCuO1種類のCu:Oの質量比が同じだと説明しているのです。
一方倍数比例の場合はCuOとCu2Oの2種類の比較を論じているのです。
これが大きな違いです。もはやこれだけで問題は解けるので下の例題をご覧ください。
定比例の法則と倍数比例の法則を見分ける問題
次の実験の中から定比例の法則、倍数比例の法則に基づく化学実験を選べ
- 一定量のステアリン酸で水面上に単分子膜を作り、その表面積を測定する
- 炭酸ナトリウム水溶液と塩化カルシウム水溶液を合わせ、反応前後の質量の総和を測定する
- 銅と酸素を反応させて、生じる酸化銅(II)のどうと酸素の質量比を測定する。
- 酸化銅(II)CuOと酸化銅(I)Cu2Oの成分元素の質量比を測定する。
- 炭素を同温・同圧で完全燃焼させ、生成した気体と酸素の体積比を測定する。
このような問題が出ます。まず1つ1つみていきましょう。
1.は、完全にステアリン酸の単分子膜からアボガドロ定数を導く実験です。
2.は、質量保存の法則を導くための化学実験です。
5.は、気体反応の法則です。
重要なのは、3,4ですよね。このどちらが定比例の法則で、どちらが倍数比例の法則かを見抜くのです。
3は銅と酸素のを反応して
登場人物がCuOの1つだけですので、定比例の法則です。
また、4は、CuOとCu2Oが出てきます。よって、登場人物が2つなので、倍数比例の法則です。このように簡単にわかるようになります。
終わりです。














