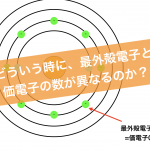
受験化学では、非常に早い段階で学ぶK殻、M殻、・・・のような電子殻。そして、その電子殻への電子が入るルールを表す電子配置を徹底的に画像をふんだんに使って解説しました。
それほどよく出るわけではありませんが、出た時に困る問題があります。それが、M殻に電子が入るのか、N殻に電子が入るのか問題です。
この辺りをしっかり区別できるようにして見ましょう。
※この記事は、具体例と画像が多いので2分ほどでサラサラ読めます。サクッと読んでみてください。
目次
電子殻とは?

原子の構造は原子核の周りに電子が運動をしている構造です。じゃあ、電子はどのような場所にいるのかと言うと、無茶苦茶に回っているわけではないのです。
原子核を太陽のようにして惑星のように回っているのです。上の図のように、電子が運動する軌道のことを電子殻と言います。そして、内側からK殻L殻M殻N殻と並んでいます。

って疑問に思うかもしれません。だって、原子核は正の電荷で電子は負の電荷ですからね。本来は原子核に引き寄せられていってもおかしくありません。
しかし、これは電子が高速で回転することで、遠心力が働いているため内側へ引き寄せられません。遠心力が原子核からの静電気的な引力(クーロン力)と釣り合います。

このように力が釣り合っているので、K殻の電子はK殻に留まります。

と思うかもしれませんね。これは、もしかしたらK殻が最初に発見された時に、もしかしたら内側に新しい電子殻が出てくるかもしれないからです。
もし、当時A殻とかにしていて、後々にA殻より内側の電子殻が出てきたら大変なことになっていたでしょう。いろんな書物の名称を変更しなければならなくなります。
なので、余裕を持って10個ほどアルファベットを残して、K殻にしたのです。
電子殻の最大収容数
電子殻の最大収容数は内側からn=1,2,3、、とすると、
2n2個が最大収容数になる。
K殻・・・2×12=2
L殻・・・2×22=8
M殻・・・2×32=18
N殻・・・2×42=32
が最大収容数です。まあ、これくらいの数字は勉強しているうちに覚えてしまうと思います。2,8,18くらいは覚えてしまったほうがいいですね。
電子配置とは?
電子殻の中に電子を入れる時のルールのことを電子配置と言います。電子配置は主に3つのルールがあります。
①電子は、原則として内側の電子殻から外側の電子殻へと配置されていく。
②電子は、各電子殻の最大収容数を超えて配置されない。
③最外殻の最大数は8個を超えてはいけない(受験テクニック)
基本的に電子は内側のほうが安定なんです。これは、内側のほうがエネルギーが低いからです。あらゆる物質はエネルギーが低い状態が安定なんです。なので内側から原則的に電子は入っていきます。
それでは、具体例で練習していきましょう。
具体例1:炭素6Cの電子配置
原子番号6、すなわち電子数6個の炭素の電子配置をK殻から順番に埋めていきます。
ステップ1:K殻の最大収容数2個を埋める

まずは、K殻へ2個の電子が埋まります。
ステップ2:L殻に残りの4個の電子を埋める

6個のうちのK殻の2個以外の電子をL殻に収容します。
具体例2:カリウム19Kの電子配置
原子番号19、すなわち電子数19個の炭素の電子配置をK殻から順番に埋めていきます。
ステップ1:K殻の最大収容数2個を埋める

ステップ2:L殻の最大収容数8個の電子を埋める

ステップ3:M殻に最外殻最大収容数8個の電子を埋める

ステップ4:N殻に残りの1個の電子を埋める

具体例3:スカンジウム21Scの電子配置
原子番号21、すなわち電子数21個の炭素の電子配置をK殻から順番に埋めていきます。
ステップ1:K殻の最大収容数2個を埋める

ステップ2:L殻の最大収容数8個の電子を埋める

ステップ3:M殻に最外殻最大収容数8個の電子を埋める

ステップ4:N殻に2個の電子が収容される

ステップ5:M殻が最外殻ではなくなったので安心してM殻に1個入る


いや〜この疑問は湧くでしょうね〜。
間違いなく湧きますね〜。このN殻に2個だけ収容される理由は、電子軌道(オービタル)を学ばないといけません。ここに突入すると、大幅に受験化学を逸脱します。
なので、めちゃくちゃ公開するか迷っているんですよ。今の所は公開していませんが、いずれその理由がわかるようになります。
最後に
いかがでしたか? 最後の方、やや難しく理解し難いところが出てきました。ScなどのN殻に2個電子入った後にもう一度M殻に電子が入り始めるっていうパターンですね。
しかも意外と問われる時は、こういうところをついてきますので気をつけてください。オービタルを使った説明も近日していこうと思います。
次回は最外殻電子と価電子について解説していこうと思いますので、次の記事もぜひお楽しみに!