最外殻電子と価電子は違いがわかりにくくよくわからなくなっている人も多いでしょう。大抵の電子は一緒なのですが、唯一希ガスのみが異なるのです。
前置きなんていらねえから、とっとと最外殻電子と価電子の違いを知りたい人は、こちらから速攻でこの記事の該当箇所に飛べます。
目次
最外殻電子と価電子の定義は?
最外殻電子は、その名の通り最も外側の電子殻にある電子のこと。
最外殻電子のうち、原子がイオンになったり、他の原子と結合したりするのに使われる電子のことを価電子という
このような定義です。最外殻電子は、最も外側の電子殻の電子で、価電子は反応に関係する電子のこと。
でも、
だいたい最外殻電子って反応に使われるんですよね。
なので、大抵の場合は最外殻電子=価電子です。

このように炭素の場合は、最外殻電子数と価電子数が同じく4個です。

カルシウムは、このように最外殻電子数2個で価電子数が2個で同数です。
最外殻電子と価電子に違いが出るときは?

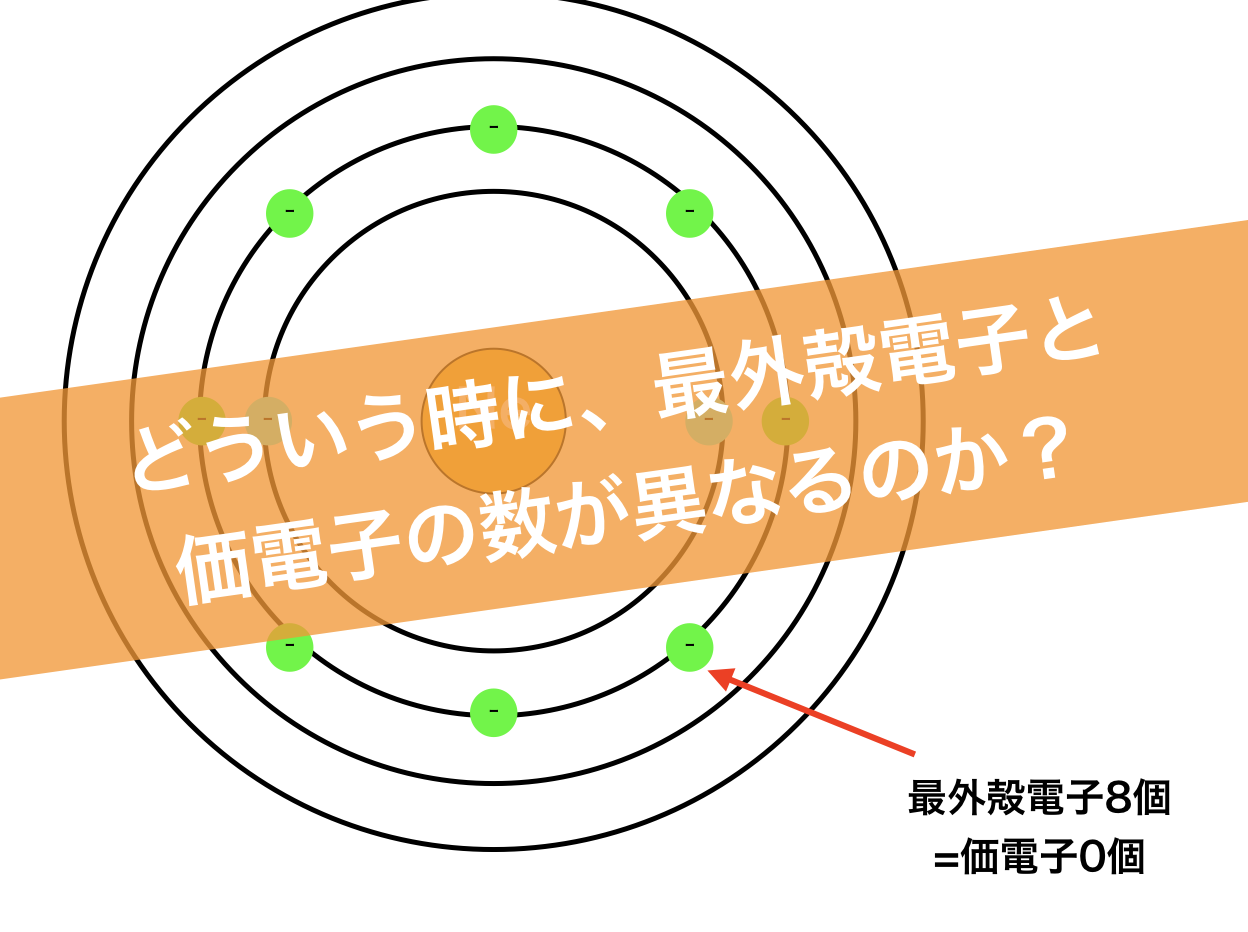
という疑問ですが、大半の原子は最外殻電子と価電子が同じです。だけども、最外殻電子数と価電子数が違う奴らもいるんです。そいつらが、「希ガス」です。

この18族元素たちを希ガスといい、この希ガスは、最外殻電子と価電子が一致しません。希ガスの価電子は全て0です。



このように、最外殻電子が満タンな状態を閉殻構造といいます。閉殻構造は、原子の中で最も安定な状態で、安定すぎて反応しません。
よって、希ガスの場合は、最外殻電子があってもその全ての電子が反応に関わりません。よって、希ガスは価電子は0になるのです。
最後に
今回は、かなり基礎的な内容を解説しましたが、この「化学受験テクニック塾」では、理論化学の計算方法や有機化学構造決定に役立つ知識、無機化学の覚え方などを公開しています。
また、順番を追って学びたい人は、メルマガへ登録することをオススメします。現在期間限定で理論化学の計算の裏技「理論テンプレート」をプレゼントしています。また、登録2日目のメルマガで動画講義もプレゼントしています。
過去にない凄まじいプレゼントなので、ぜひ登録をお願いします。