分子結晶ってなんとなく掴みにくいですよね。共有結合の結晶と金属結晶とイオン結晶までは理解できていたのに、分子結晶が出てきた瞬間、共有結合の結晶との違いがわからなかったり、分子結晶をいまいち理解できない人も多いです。
なので、今日は分子結晶について具体例を交えながらまとめていきたいと思います。最後に共有結合の結晶との見分け方も解説していますので、ぜひそこまご覧ください。
ちなみに、分子結晶を作るためには分子同士が分子間力で繋がるのですが、最低限分子間力は知っておいてください。分子間力は「ファンデルワールス力」と「水素結合」を知っておけば大丈夫です。
この2つを知らない人は、まず下の記事からこの2つの知識だけ身につけておいてください。
目次
分子結晶とは?分子結晶の特徴や性質まとめ
分子同士が分子間力で集合してできる結晶のこと
また、分子結晶はファンデルワールス力で結合をしている場合が多くて、常温でもめっちゃ簡単に結合を切ることができます。
分子結晶の性質
- やわらかい
- 融点・沸点が低い
- 昇華しやすいものがある(ヨウ素I2、ドライアイスCO2、ナフタレンC10H8)
このような分子結晶(ドライアイス)があります。

これを結晶としてとどめているのはファンデルワールス力です。少し熱を得ただけで熱振動で、この結晶格子を振り切っていきます。
なので、分子結晶はかなり不安定な状態です。そのため、固体→気体へと昇華したりします。
分子結晶の構造の特徴
分子結晶を作るファンデルワールス力は、結合の方向がありません。どういうことかというと、共有結合だと結合する方向が決まってしまいます。
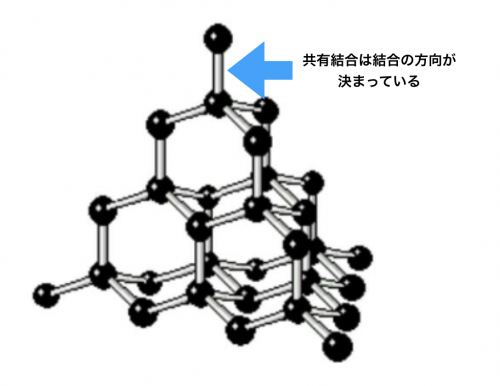
例えば上はダイヤモンドです。ダイヤモンドの構造は、正四面体方向の結合になっているので方向が決まっていますよね。これだと、スキマが出来て密度が小さくなります。
でも、ファンデルワールス力は、結合の方向が決まっていません。接触できるなら接触できるだけ結合は大きくなります。
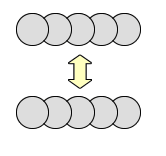
なので、最密構造を取りやすいんですよね。最密構造といえば、「立方最密構造(面心立方格子)」と「六方最密構造」の2つですよね。実際に分子結晶は面心立方格子になりやすいんですよ。
ちなみに、分子結晶でもっともよく出題される氷は、水素結合で分子結晶を作ります。水素結合は結合する方向が決まっているので、密度が小さいスカスカの構造になります。

正四面体の方向にしか水素結合できない。
分子結晶の具体例
氷(最頻出)

氷は、有名な分子結晶の中では唯一水素結合で結晶になっているものです。氷はご覧の通り正四面体方向に水素結合しますので、スカスカ構造になっています。
実は、水の方が密度が大きいんですよ。なので、非常に珍しいのですが体積が液体<固体なんですよ。つまり密度が液体>固体なんです。
ドライアイス

ドライアイスは二酸化炭素分子がファンデルワールス力で結合した分子結晶です。二酸化炭素分子はファンデルワールス力で密にくっつきますので、面心立方格子(最密構造)で配置されます。
ただ、。同じ面心立方格子の金属には、金属原子の間に自由電子があって結合を繋ぎ止めておいてくれています。分子結晶の中の分子間で働いているのはただのファンデルワールス力です。
ヨウ素

ハロゲンの中でも常温でF,Cl,Br,Iの中で常温で固体なのはヨウ素のみです。要素は分子量が大きいので、ファンデルワールス力も大きく分子結晶になります。
斜方硫黄

斜方硫黄は、S8硫黄分子がこのような王冠型になっております。このように王冠が重なっていくようにファンデルワールス力で結合し分子結晶を作っていきます。
下図のように硫黄分子は接触しやすい構造を取っているので、

このように、ファンデルワールス力で結合して斜方硫黄が分子結晶になっていきます。
ナフタレン
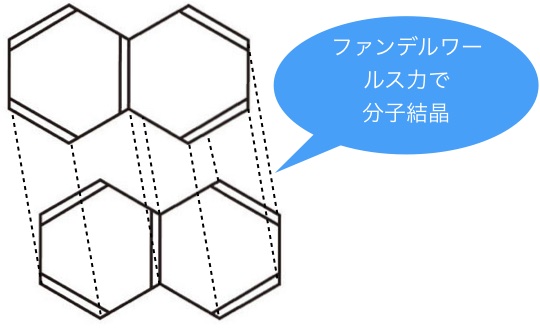
ファンデルワールス力について思い出して欲しいのですが、ファンデルワールス力は平べったく平面的な方が大きくなるのです。

こいつのように枝分かれがあるよりも、

このような、枝分かれがない平べったい構造の方が圧倒的に接触しやすいので、ファンデルワールス力が大きいのでした。
ナフタレンもこのように、平べったくファンデルワールス力が働きやすいので分子結晶をとります。
発展:フラーレン

フラーレンって、分子自体がC60というデカイ分子なんですよ。フラーレンはサッカーボール型の分子でして、下のような分子構造です。
ちなみに、これはまだ分子結晶じゃないですよ。これはただの分子です。この分子が集合して分子結晶を作るんですが、この分子結晶の集まり方が面心立方格子なんですよ。

このようになります。入試問題でも
・単位格子内のフラーレン分子の数
・フラーレンの分子結晶の密度
などが出題されます。フラーレンのみを扱っている記事を用意しましたので、実際にどのように問われるのか詳しく解説しております。
【ごめん】共有結合の結晶と分子結晶の違い

基本的に共有結合の結晶と分子結晶はある程度覚えるべきです。
塩にしくしく
SiO2、Si、C、SiC
ですが、基本的に共有結合の結晶と分子結晶を迷うのはSiO2です。SiO2が共有結合の結晶で、CO2が分子結晶だからわかりにくいんですよ。この見分け方はこちらの記事でバッチリ書きましたので、こちらで詳しくみてください。
強いていうならば、受験化学においては共有結合の結晶は14族が多いです。14族のように価電子が4箇所にあるものが共有結合の結晶になります。
ちなみに、14族が共有結合の結晶を作るっていうのは、完全に受験化学でしか通用しません。例えば、GaAs(ガリウムヒ素)なんかも共有結合の結晶です。13族と15族の結晶でして半導体分野で大活躍します。2014年のノーベル賞の青色LEDもGaN(窒化ガリウム)の半導体です。このように14族以外でも共有結合の結晶は存在します。
最後に
分子結晶をここまで詳しく説明している(面心立方などと絡めて)コンテンツはなかなかないと思います。教科書にもこのようなまとめられ方はされていなかったと思うので、もしかしたら戸惑っているかもしれません。















