こんにちは。
同素体について、個別ではいろんな記事を書いてきましたが、総まとめの意味をかねて、同素体の覚え方から、同素体とは何か? そして、同素体のそれぞれの物質まで徹底的に解説しました。
もう、この記事さえ読めば免許皆伝です。
この記事は、網羅性を1記事で保つために詳しい説明を別ページに設けています。なので、この記事は同素体の辞書のようにお使いください。ブックマーク、はてブ、Twitterで呟いておくなどをして、いつでもアクセスできるようにしておいてください。
※この記事は、要点を解説し、別の記事で詳しく解説するスタイルを取っています。なので、さらっと要点のみ知るためには2〜3分で読み終われます。
目次
同素体とは
同じ元素の単体どうしのこと。
 同じ元素の原子からできる単体で、上のビー玉みたいな例のように、3個で1つの単体。2個で1つの単体の場合があります。同じ素材(元素の原子)を使うんだけど、単体が異なるものになる場合を同素体と言います。
同じ元素の原子からできる単体で、上のビー玉みたいな例のように、3個で1つの単体。2個で1つの単体の場合があります。同じ素材(元素の原子)を使うんだけど、単体が異なるものになる場合を同素体と言います。
地味に「単体」であることって重要です。たとえば、一酸化炭素COと二酸化炭素CO2って同じ元素でできていますよね。なので、同素体だと勘違いする人もいます。
ですが、同素体は単体ですので、同じ元素からできているけれどCOとCO2は同素体とは言いません。
同素体の覚え方と代表例

同素体は、SCOP(スコップ)で覚えるべし
同素体は、硫黄(S)、炭素(C)、酸素(O)、リン(P)の四元素を覚えておけば、受験は乗り切ることができます。この四元素をまとめて「SCOP(スコップ」と覚えます。
これらの同素体の性質が問われます。
| 元素記号 | 元素名 | 単体名 | 化学式 | 色 | 特性 |
|---|---|---|---|---|---|
| S | 硫黄 | 斜方硫黄 | S8 | 黄色 | 非常に安定 |
| 単斜硫黄 | S8 | 黄色 | 常温で放置すると斜方硫黄になる | ||
| ゴム状硫黄 | S(組成式) | 低純度で褐色 | 常温で放置すると斜方硫黄になる | ||
| C | 炭素 | ダイヤモンド | C(組成式) | 無色透明 | 非常に固い 電気伝導性なし |
| 黒鉛(グラファイト) | C(組成式) | 黒色 | もろい(砕けやすい) 電気伝導性あり |
||
| フラーレン | C60,C70 | 紫(溶液中) | ナノテクノロジーに関与 | ||
| O | 酸素 | 酸素 | O2 | 無色 | 無臭 助燃性有り |
| オゾン | O3 | 淡青色 | 特異臭 紫外線吸収効果 |
||
| P | リン | 黄リン | P4 | 黄色 | 有毒、不安定 |
| 赤リン | P(組成式) | 赤色 | 無毒、安定 |
それでは、これらを詳しく解説していきます。¥どれも、無機化学と合わせてよく出題されますので、必ずマスターしておいてくださいね。
硫黄の同素体

硫黄の同素体は、王冠型の分子であるS8の斜方硫黄と単斜硫黄、そしてSxと高分子のゴム状硫黄の3つがあります。
| 斜方硫黄 | 単斜硫黄 | ゴム状硫黄 | |
| 分子構造 | 王冠 | 王冠 | 不定形(陰毛) |
| 分子結晶 | 塊状 | 針状 | ゴム状 |
| 融点 | 112.8℃ | 119.3℃ | 不定 |
| 密度(g/cm3) | 2.07 | 1.96 | 1.92 |
| 色 | 淡黄色 | 黄色 | 黒褐色 |
| 溶解性 | CS2に溶解 | CS2に溶解 | 不溶 |
詳しくは『硫黄の同素体の性質、生成実験、構造の違いをまとめてみた』の記事に詳しく解説しています。また、そのほかにも、斜方硫黄と単斜硫黄の違いも別記事にまとめています。
炭素の同素体

炭素の同素体をきっちりまとめてみました。炭素の同素体は、ダイヤモンドと黒鉛とフラーレンがあります。性質は下の表。
| 黒鉛 | ダイヤモンド | フラーレン | |
|---|---|---|---|
| 化学式 | C(化学式) | C(組成式) | C60,C70(,C80) |
| 色 | 黒色 | 無色透明 | |
| 構造 | 炭素の六角形からできる層がファンデルワールス力で結合 | 正四面体構造が連続 | C原子がサッカーボール型に結合 |
| 性質 | やわらかい もろい 電気をよく通す 光沢あり |
極めて硬い 電気を通さない |
ナノテクノロジーに利用 |
炭素の同素体では、入試で出題されるポイントがあり、かなりよく出題されます。
頻出ポイント1:黒鉛とダイヤモンドの違い

ダイヤモンドと黒鉛は炭素の同素体のメインの2つです。基本炭素の同素体といえば、この2つがでます。この2つって同じ炭素からできているのに、興味深いくらい性質が違います。
そこで、この2つの性質の違い。またその性質の違いが起きる理由を記述させられる問題が劇的に出題されます。なので、こちらの記事でしっかり記述できるようにしておいてください。
頻出ポイント2:ダイヤモンド結晶構造の計算問題
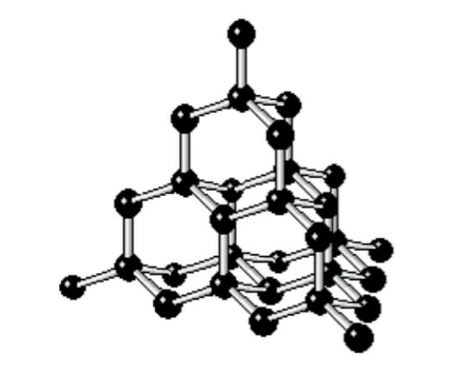
引用:http://bb.phys.se.tmu.ac.jp/~bb/pukiwiki/index.php?Neutron_xray_2%2FC
このダイヤモンド型の結晶を結晶格子に入れて、計算する問題が頻出です。しかもダイヤモンドだけでなく、この構造を取るのは、水、二酸化ケイ素など、様々な物質に応用可能な計算です。
炭素の同素体を学ぶだけでなく、いろんな物質の計算に応用可能だと思って、しっかり学んでください。
たまに出るポイント:フラーレンの構造の計算問題

フラーレンはサッカーボール型の分子で、この分子同士が分子結晶を作っています。このフラーレンの性質は難しすぎるので直接問われることはありませんが、フラーレンの分子結晶の構造についての計算問題が時々出題されます。
なので、こちらの記事でフラーレンの知識や計算問題を一度目を通しておいて下さい。
参考:フラーレンとは?入試問題に出題されるポイントをまとめてみた
酸素の同素体

酸素の同素体は、酸素とオゾンです。(実際はO4やO8も存在しますが、受験では全く必要ありません)
| 酸素(O2) | オゾン(O3) | |
|---|---|---|
| 分子式 | O2 | O3 |
| 構造 | 直線型 | 折れ線型 |
| 色 | 無色 | 淡青色 |
| におい | 無臭 | 特異臭 |
| 特性 | 助燃性有り | 紫外線吸収効果 |
酸素はあまりにも身近なので、ほとんどの人がオゾンのことをよく知らないと思います。オゾンは酸化力を持ちますが、その理由はなんなのかをまとめてみました。
また、オゾンの製法である「無声放電」も知らない人が多いです。こちらの記事でオゾンの受験に必要な知識は身につけることができます。
リンの同素体

リンの同素体は、黄リンと赤リンです。
| 黄リン | 赤リン | |
|---|---|---|
| 化学式 | P4
(分子式) |
P
(組成式) |
| 構造 | 正四面体(無理やり) | 黄リンが結合している |
| 毒性 | あり | なし |
| その他特徴 | 自然発火する
(水中に保存) |
マッチの側面 |
リンの性質は構造からわかります。黄リンは不安定で、赤リンは穏やかな物質だと思っている人もいますが、普通の物質に比べれば赤リンも十分不安定です。
赤リンはマッチの壁の側面です。

もちろん、黄リンは何もしなくても酸素と化合して、その時の酸化熱で発火しますが、赤リンもこすった時に発火します。黄リンの反応性は、全てリンの分子であるP4構造が不安定だからです。
このP4の分子の構造から、なぜ黄リンが不安定で有毒で、勝手に酸素と結びついて発火してしまうほどお茶目さんなのか を記事でまとめましたので、こちらをご覧ください。
同素体と同位体の違いは?

同素体と同位体の違いについて、記述問題で出題されることがあります。個人的にはクソくだらない問題だな〜と思うわけですが、なにぶん名前が似ているもので、混乱する人もいます。
なので、同素体と同位体の違いをしっかり区別して学んでみていきましょう。
最後に
この記事では、かなり同素体を網羅的にまとめました。ややオーバーキルです。ですが、これでもう付け入る隙はありません。記述が来ても問題なしです。
ってなわけで、ここで紹介している記事もしっかり読み込んでおいてくださいね!