こんにちは。
僕はブログの中で「濃硫酸は強酸なので、、、」と記述した部分がありました。すると、

と言う返信を貰いました。
はい、僕の書き方が悪かったです。というか、書き方が間違っていました。
しかし!!!
濃硫酸自体が強酸であることは間違い無いです。
濃硫酸は弱酸”性“だというのは間違いありませんが、水素イオンを投げる力はピカイチです。そのあたりの違いを話していきたいと思います。
結論、「濃硫酸は弱酸性だけど、当然硫酸なんだから強酸」というふうに覚えてください。
目次
濃硫酸は弱酸性?なぜ硝酸や塩酸の揮発性酸遊離反応に使える?
と書かれているのですが、濃硫酸は弱酸なのではないのですか?
濃硫酸は、塩酸や硝酸よりも弱い酸になるのではないでしょうか?
この質問は、
「揮発性酸遊離反応とは?塩化水素や硝酸の製法である理由とは?」
この記事に来ました。
記事該当部分の画像

質問が来たのは、この画像の『強酸が濃硫酸のもの』と言う部分です。
濃硫酸は弱酸だから弱酸遊離反応の強酸にはなれなくない? っていう質問です。
濃硫酸はpH的な酸の強さでいうと弱酸性
pH的に見ると濃硫酸は完全に弱酸性です。
pHというのは何か知っていますか? これは、水素イオン濃度をわかりやすい数値に表したものです。
つまり、水溶液中に水素イオンが沢山あればあるほど強酸であるという指標です。
↓この画像のように「H+」がたくさん溶液の中にいれば強酸性です↓

↓この画像のように「H+」がほとんどなければ弱酸性です↓

そして、濃硫酸は↓この状態になっています。

濃硫酸でよく質量パーセント濃度98%ってよく見かけますよね。この状態を想像して欲しいのです。
です。ほぼ水が無いんです!これが重要です。
強酸性ということは、溶液中にH+だらけになる必要があると言いました。
H2SO4→H++HSO4–
こういう電離反応をするからですよね?

実際の水溶液中での硫酸の電離は次のようになります。
H2SO4+H2O→H3O++HSO4–
H+をH2O(水)に投げて、オキソニウムイオン(H3O+)にするんです。
つまり、酸として電離するには水がないと強酸性にはなれないのです。
というのも、まわりに水がなくて、濃硫酸ばっかりだから、水素イオンを投げる相手がいないのです。
濃硫酸のイメージって↓こんな感じです。H2SO4だらけでH+を投げる相手の水がほぼいません。

硫酸は強酸ですが、弱酸性です。H+を投げる力は強いです。しかし、濃硫酸の場合は周りに水がないのでH+を投げることができません。結果として溶液中に「H+」はほとんどないので、弱酸性なんです。
一方希硫酸は、水で希釈した硫酸です。つまり、水が大量にいるので、水素イオンを投げる相手がいっぱい居るわけです。
↓この反応めっちゃ進みます。
H2SO4+H2O→H3O++HSO4–
まとめると
| 水 | [H+] | 水溶液の 酸の強さ |
|
| 濃硫酸 | 激少ない | 小さい | 弱酸 |
| 希硫酸 | 多い | 大きい | 強酸 |
この表のようになります。
弱酸遊離反応で重要な酸の強さとは?
では、質問のところにあった、『揮発性酸遊離反応』(濃硫酸を用いた弱酸遊離反応)について当てはめていきましょう。
弱酸遊離反応があやふやな人はコチラの記事を確実に読んでから以下を読んでください。
例えば、質問が来たのは、「NaClと濃硫酸」をまぜまぜした状態です。
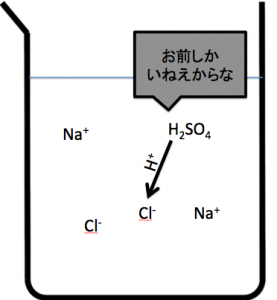
質問です。なんで硫酸は弱酸なんでしたっけ?
それは、H+を投げる相手が居なかったからですよね。
今回の反応の場合、Cl–というキャッチャーが居るのです。
弱酸遊離反応で重要なのは、pH的な強さではなく、相手に強烈にH+を投げる事なのです。
濃硫酸と言うのは、水素イオンを投げたくて投げたくて仕方が無い大谷翔平だと思ってください。
つまり、この揮発性酸遊離反応における酸の強さっていうのは地肩があるH+を投げる力があるもののことです。
「やっとCl–という獲物が出て来た!」と大喜びです。
濃硫酸が弱酸性なのはわかった。濃塩酸や濃硝酸は?

本記事で取り上げた話題って、濃硫酸しかなくないですか? 濃硝酸は?濃塩酸は?って思いますよね。HClもHNO3もそもそもH+を投げたがっている大谷翔平予備軍です。
結論をいうと揮発性のある塩酸や硝酸では不可能です。理由は塩酸や硝酸は揮発性があるからです。なので濃硫酸のように98%も濃い溶液になれないんですよ。
HClが98%だったら水よりも多いです。そしたらHClはどんどん気体になって空気中に消えていってしまいます。なので、濃硫酸だけが弱酸なのです。98%の濃度でも気体にならないからです。
最後に:硫酸は肩が強く球も速いがキャッチャーがいないと弱酸
- 濃硫酸は弱酸で希硫酸は強酸
- 濃硫酸が弱酸なのはH+を投げるキャッチャーであるH2Oが溶液に存在しないから
- 実際H+を投げる力はピカイチ強い
- このH+を投げる力が強いので脱水剤として使われる
濃硫酸は、確かにそれ単体なら水素イオン濃度が小さいから弱酸だけども、
水素イオン濃度を投げると言う肩の強さはえぐいよ! つまり少しでも獲物が居たらスゴい勢いで投げてきますよ!
言葉の問題なんですよ。
酸と酸性は違います。濃硫酸は強酸です。ですが、弱酸性です。
















以前濃硫酸が弱酸である理由を質問した者です。
わざわざ記事にしてくださって有難うございます。
これで濃硫酸の酸としての性質がむっちゃよくわかりました!
これからもどんどんコメントさせてください!
いえいえ、こちらとしても記事作成のヒントになります。
またコメントしてください!
「酸」というのは水に溶けてオキソニウムイオンを生じる「物質」のこと。「強酸」や「弱酸」というのもそれぞれオキソニウムイオンを生じる度合いの違いこそありますが意味や概念としては「酸」と同じです。
「強酸性」や「弱酸性」と言うのはその「液性」を示す言葉であり、したがって濃硫酸が「弱酸」というのには語弊があり、
濃硫酸は「弱酸性」と言ったほうがより適切なように感じます。要するに硫酸が「酸」というのと希硫酸(濃硫酸)が強酸性(弱酸性)というように「酸」と「酸性」というのを区別したほうが良いのではないかと思った次第です。
ありがとうございます。修正していこうと思います。
濃塩酸 濃硝酸も同様に弱酸ですか?
濃塩酸も濃硝酸も濃硫酸ほどの%は無理です。
なぜならそれだけ水が少なければすぐに揮発してしまうからです。
だから濃塩酸といえでもある程度の水が必要ですので、電離して強酸になります。
ワカリヤスィィー
すみません。最後の重要ポイントの所では濃硫酸は弱酸とありますが最後の赤い四角の所では酸と酸性は違う、濃硫酸は強酸だか弱酸性とあります。混乱してしまいました。どういうことでしょうか?ごめんなさい。
酸は、H+を投げられる物質のことで、酸性は液性のことです。水に溶けたときのpHのことです。
硫酸は強酸だけど、濃硫酸は弱酸性とした方がわかりやすかったですね。
大谷翔平選手の例え分かりやすすぎでした!!
ありがとうございます!
よかったです!
記事に大谷翔平が追いついてきました