こんにちは。
昨日このようなコメントがきました。

はじめまして。
記事を見ました。質問があります。硫酸水素ナトリウム NaHSO4 と、硫酸ナトリウム Na2SO4の違いがいまいちよく分からないのですが教えて頂けませんか?
これは、気体の発生で 濃硫酸が沸点の高い不揮発性の酸であることを利用し、「塩化ナトリウムに濃硫酸を加えて熱し、塩化水素を発生させる」というところで疑問に思いました。
” 2NaCl + H2SO4 → 2HCl + Na2SO4 “
という反応式を立ててしまいました。もし、’’硫酸の不揮発性’’という性質以外に何か使う知識があれば教えて頂けると幸いです。
HClの製法だね!
なんでNa2SO4ができずに、NaHSO4までしかできないの?
ってことだね
ここにつまづく人って結構多いです。
気体の製法を勉強した人なら、必ず一度は通る道だと思われます。なので、この記事では、揮発性酸遊離について、学び、
その後にこの理由を説明しておきたいと思います。
目次
揮発性酸遊離反応とは、弱酸遊離反応とセットだ!
揮発性酸遊離反応とは、ほとんど弱酸遊離反応と起っている反応は同じです。そのうち、強酸が濃硫酸のもの、が揮発性酸遊離反応と言います。

って思う人も多いと思います。ちなみに、ちがいというのは揮発性酸遊離をつかうのは、『割と強酸』と言う事です。
また、濃硫酸と固体のNaClなどを使うので、ほとんど水が無い状態で反応させます。これが弱酸遊離との違いです。
揮発性酸遊離反応である必要は?
これは、HClやHNO3のような強酸を取り出す反応だからなんです。
弱酸遊離反応は、より強い酸がより弱い酸にH+を投げつけて、強酸がイオン化弱酸が分子になる反応です。
↓詳しい弱酸遊離反応の説明はこちら↓
ですが、今回取り出すのは、HCl、HNO3などの、『強酸』なんです。
たしかに、硫酸の方が塩酸や硝酸より強酸ですが、すんなりH+を受け取るでしょうか?
いや、受け取らないですよね。電離したがる強酸達は、そう簡単に、H+を受け取りません。
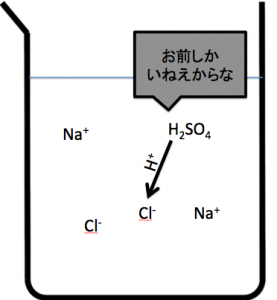
こんなところに水があったらどうでしょう。普通の弱酸遊離反応です。希硫酸はかなり水、H2Oを含んでいます。てことは、Cl–がH+を受け取らせる身代わりとして、水を使ってきます。

硫酸が投げたH+がH2Oが受け取って、H3O+となります。
本来目的はHClを取りだす事なんですから、Cl–+H+→HClが起ってほしいんです。
H2O+H+→H3O+
だから、HClが生成出来ないのです。濃硫酸+固体のNaClをつかうともはやまわりには、水がありませんよね。
てことは、Cl–は水を盾にして逃げる事が出来ないわけですよ。
加熱の有無
ちなみに加熱はいります!加熱する事でHClが飛び出てくるのです。
揮発性酸か不揮発性酸かの見極め

揮発性酸か不揮発性なのかを見極める方法はとっても簡単です。
それは、
濃硫酸だけが不揮発性酸です。
(※リン酸も不揮発性ですが、塩酸や硝酸より酸が弱いから使われる事は無いです)
ほんでそれ以外の有名な、HCl(塩化水素)、HNO3(硝酸)は揮発性酸であると言う風に覚えておけばいいです。
Na塩は水中で完全電離する?
Na塩やK塩は、受験では、完全電離すると覚えてください。
↓Na塩が完全電離する理由はこちら↓
ということで、NaClはHClが電離している状態とお考えください。
Na2SO4は硫酸が電離しているとお考えください。
つまり、強い酸ほど、Na塩やK塩、Ca塩、Ba塩になりたいわけです。
極性を最もの同士はよく溶けます。
↓似た者同士よくとけるという現象↓
なので、イオン結晶(中和の塩)は、水に溶けやすいのです。
(たまに、難溶性塩というものがあり、無機化学で沈殿反応として覚えなければならない奴です)
強酸同士の揮発性酸遊離反応は電離定数の知識が必要!

先ほどいただいた質問、なぜ
2NaCl+H2SO4→Na2SO4+2HCl
にならないか?
でしたね?これがもし、酢酸やったら何も悩まなくていいのです。
2CH3COONa+H2SO4→2CH3COOH+Na2SO4
ってなります。
これは、酢酸が弱酸だからです。さっき言ったように、揮発性酸遊離反応は、弱酸遊離反応でもあります。
そして、強酸ほど電離する
=イオン化する
=Na塩、Ca塩などになる。
と言うわけです。
で、硫酸、塩酸、硝酸は各々強酸なわけですよ!
ということは、硫酸vs塩酸なんてめっちゃややこしくなりそうじゃないですか?
しかも、硫酸って、H2SO4やから、2価の酸ですよね。
硫酸は、2価だから、第1電離と第2電離でも酸の強さが違うわけです!
というわけで、
硫酸vs塩酸、
硫酸vs硝酸を
見て行こうと思います。
硫酸VS塩酸
実は、NaHSO4までしかいかない理由がこの電離定数の違いによる物なのです。
酸の強さの順番が、硫酸第1電離>塩酸>硫酸第2電離なのです。
だから、H2SO4+NaCl→NaHSO4+HClは起ります。
なぜなら、硫酸第1電離は塩酸より酸が強いからです。
ただし、NaHSO4+NaCl→Na2SO4+HClはおこりません。
なぜなら、硫酸第2電離は塩酸より酸が弱いからです。HClの方が強酸なんだから、強酸のHClがNaClになって、電離しているのは自然なのです。
硫酸vs硝酸
KNO3+H2SO4→HNO3+KHSO4となり、HNO3が遊離して来るのは大丈夫だと思います。
じゃあもう一段階行くか?というと、そうではありません。
硫酸の第1電離>硝酸>硫酸第2電離と言う順番で酸の強さが変わって行くからです。
なので、2回目の揮発性酸遊離反応、
KNO3+KHSO4→K2SO4+HNO3
は起りません。
まとめ
揮発性酸遊離反応をする理由、そして、なぜ、Na2SO4が出来ないのか理解できましたか?
ちゃんと理解したら、定着させるために問題を解いて、行きましょう!























昨日質問した者です。
新たに疑問がでてきたので、良かったら教えてください。
硫酸の第1電離>硝酸>硫酸第2電離 とのことですが、これは高校化学のどの範囲の事項なのでしょうか。
初めて知ったので、他にこれと似た内容で覚えなければいけないことがあったら、ぜひお願いいたします。
また、先生に聞いたら、「Na+, Cl-. H+, HSO4- に電離し、塩酸の方が濃硝酸よりも沸点が低く、塩化水素という気体が発生する」ということだったのですが、なかむらさんの説明と合わせて頭に入れておいた方が良いのでしょうか。
記事を改めて書いて頂いて、とても嬉しいです。
内容はしっかり理解することができました!!
まあ高校化学では、
覚えろ!って所です。
強いて言うなら、
電離平衡のところです。
Ka=[H+][HSO4–]/[H2SO4]で、電離度が大きいほど、強酸って言うのがわかりますか?
この値が、硫酸>塩酸>硫酸第2電離なんですね。
まあ気体生成反応で弱酸遊離反応を使う事はよくありますね!
入試に出るさらし粉の反応まとめ!化学式を2倍する方法とは?
とか見てもらえると、
さらし粉から塩素を発生させる
製法とかもきちんと書いています。
ご返信、ありがとうございます。
では、硫酸の第1、第2電離の、硫酸以外のものでも 第1>第2 の強さになるということで良いのでしょうか。
何度も質問してしまってすみません。
はい、第1電離は第2電離より大きいです。
「有機物の酸の強さも」
スルホン酸>カルボン酸>炭酸第1電離>フェノール>炭酸第2電離
って言う順番です。
大変よく分かりました!!
いつも本当にありがとうございます。
これからも、ぜひよろしくお願い致します。
こちらこそ!
これからもバンバンコメント
お願いします!
塩酸vs硝酸はどうなるのでしょうか
両方揮発しちゃう。
この反応は硫酸が不揮発性であることも重要。
目次の少し下に、
「そのうち、強酸が濃硫酸のもの、が不揮発性酸遊離反応と言います。」
と書かれているのですが、濃硫酸は弱酸なのではないのですか?
濃硫酸は、塩酸や硝酸よりも弱い酸になるのではないでしょうか?
硫酸は「強酸」です。
濃硫酸は「弱酸性」です。
酸という言い方をしたときには、水素イオンを投げる力が強いもののことを言います。
濃硫酸が弱酸である理由は98%の濃度で硫酸が多数あるので、H+を投げる相手がいないからです。
強酸性溶液とは、H+濃度が大きい溶液のことです。
濃硫酸はH+を98%が硫酸だからH+電離できないので、強酸なのに弱酸性なのです。
>濃硫酸は、塩酸や硝酸よりも弱い酸になるのではないでしょうか?
濃硫酸は「弱酸性」なだけで、強酸です。
ありがとうございます!
濃硫酸が弱酸と言われている理由もわかって、とてもスッキリしました。
これからもこのサイトを勉強に使わせていただきます。
宜しくお願い致します。
ありがとうございます!
よろしくお願いします!
先生、初めまして。
質問なのですが、濃硫酸の不揮発性の利用の例として、ホタル石(CaF2)に濃硫酸を加えて熱するとフッ化水素(HF)ができる、というものが自分の参考書に載っていました。
もしかしてこれも弱酸遊離反応の一種でしょうか?
また、もしそうだとしたら、何故この反応は酸・塩基反応の一種としてでなく、こっちのカテゴリーに含まれてしまうのでしょうか?
遊離反応かどうかだけでもいいので、宜しければお願いします!
弱酸遊離反応の一種です。揮発性酸遊離反応ですね。
また、弱酸遊離反応も酸塩基の反応の一種です。
そうだったのですね。ちょうどこの分野を勉強しているところだったので、大変参考になりました。
これからもこのサイトを勉強に使わせていただきます。
大変ありがとうございました!
はじめまして。
「HClの方が強酸なんだから、強酸のHClがNaClになって、電離しているのは自然」とありましたがこれはどういうことでしょうか?
弱酸遊離反応の記事を読んでください。
https://xn--qck0d2a9as2853cudbqy0lc6cfz4a0e7e.xyz/theory/doraemon
弱酸より強酸の方が電離したいよね〜ということです。
硝酸の製法はオストワルト法以外
教科書に載っていないので不揮発性を
使った化学式を教えてほしいです。
流石に自分で作れるでしょう。
質問よろしいですか?
硫酸第一電離>塩酸>硫酸第二電離 と書いてあるのですが、硫酸第一電離がH2SO4のことで、硫酸第二電離がNaHSO4という解釈で合っていますか? つまり酸の強さが H2SO4>HCl>NaHSO4の順番だという認識で合っているでしょうか?
電離とはその名の通り電気的に離れることなので、
第1電離=H2SO4
ではなく、
第1電離=(H2SO4がH+を投げること)
ですね。
第2電離=(HSO4–がH+を投げること)
と解釈してください。
>つまり酸の強さが H2SO4>HCl>NaHSO4の順番だという認識で合っているでしょうか?
あってます。
H2SO4>HCl>HSO4–
NaClはHClが電離している状態と考えていいのはなぜですか?
HClの塩だからですね。
結局、揮発性酸遊離反応では本来強酸の物質が相対的に弱酸として遊離するということであってますか?
そういうイメージです。
質問です。
「強酸を弱酸遊離で取り出す」ために「揮発性酸遊離反応」とはどうゆうことなのでしょうか。弱酸遊離の反対が揮発性酸遊離という解釈でも良いのですか?
書き方が悪かったですね。
修正します。
ただ記事全体を見てもらえれば、そのような解釈にはならないはずです。
強酸のHClやHNO3を取り出すにはより強い酸の濃硫酸を使う必要があるということです。
硫酸が塩酸と反応してNaHSO4になるのはわかりました。
その後ですが、塩酸の電離の方が硫酸の第2電離より大きいから塩酸がNaHSO4にHプラスをなげることにならないんですか?
ならないですね。
硫酸第1電離のほうが塩化水素の電離よりも強酸なので。