物質量(モル)は何気なく当たり前に使っているので、よくわからないモルはダースみたいなもんだよ。とかよく言われるんですが、それだけ言われてもちょっと意味がわからないですよね。
歴史的にどのように1mol=6.02×1023個と決まったのか知っておく必要があります。これは、こういうのを知っておいたら理解できてスッキリするからではなく、実利があります。
物質量molが決定される歴史をたどる問題が頻繁に入試で出題されるからなのです。molはどのように定義されるのかを
また、モルをダースと同じだと考えるのは非常に危険です。なぜなら、ダースは明確に12個と決まっていますが、モルは質量と連動して決められた数値だからです。
今の所なんのことを言っているかわからないでしょう。ですが、別のところでこの知識をご紹介したときの返信メールがこちら。
目次
物質量モルとは?
モルって個数をまとめたものです。化学反応式っていうのは、個数が重要なんですよ。例えば水素と酸素が化合して水ができる反応があるじゃないですか。
2H2+O2→2H2O
これって

このように2個の水素分子と1個の酸素分子が化合して2個の水分子ができる反応です。化学反応式の係数の比は突き詰めると、個数の比ですよね。つまり、化学反応では個数が重要なんです。
じゃあ、個数が重要だとは言ったものの、

って思ってしまうでしょう。これは、原子はあまりにも小さい粒粒なので、そこそこの質量集めるだけでもとんでもない個数になってしまうんです。
602000000000000000000000個ですよ。こんなので計算するのって幾ら何でも非効率過ぎます。なので、この数字をまとめて1molって定義したんですよ。
イメージとしては、モルはダースに似ています。1ダース=12ですよね。鉛筆36本のことをなんと言いますか? 3ダースですよね。鉛筆6本のことをなんと言いますか? 0.5ダースですよね。
これと全く同じで、12.04×1023個のことを2molと言いますし、3.0×1023個のことを0.5molと言います。
アボガドロ定数6.02×1023個はどのように決まった?
原子量にgをつけた量の中に含まれる原子数をアボガドロ数と定義し、そのアボガドロ数の集団を1モルと呼ぶ。

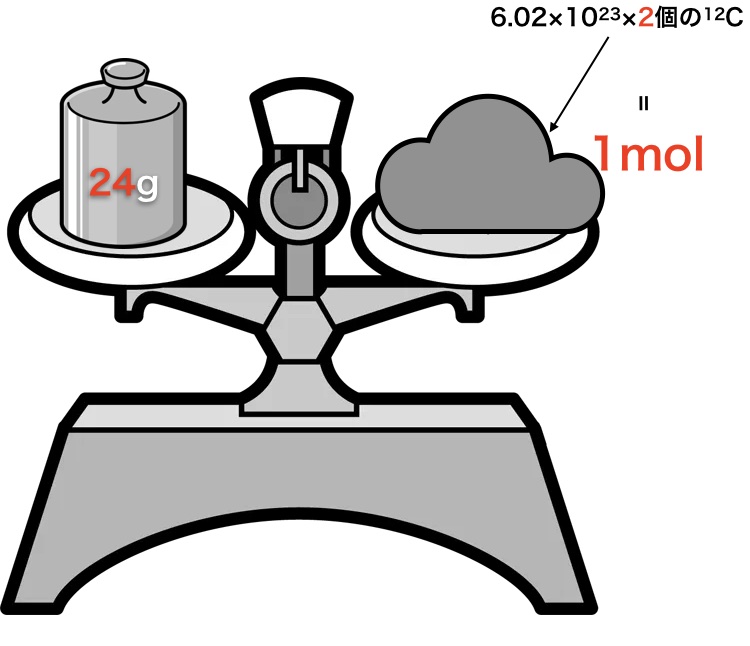
上の天秤のように12gの重りにつりあうように12Cを大量に集めたとします。すると、その個数が6.02×1023個なんですよ。この時の6.02×1023個のことをアボガドロ数と言いまして、この個数の塊をモルと言います。
別に12Cに関わらず1Hなども1g分集めるには、アボガドロ数個だったのです。
1Hを1gになるまでに必要な個数N1
12Cを12gになるまでに必要な個数N2
16Oを16gになるまでに必要な個数N3
この時のN1=N2=N3=アボガドロ数6.02×1023なんですよ。

はい、変わります。今の時代は相対質量の基準を12C=12と定められて統一されているので1モルは6.02×1023個と決まっています。しかし、相対質量の基準を変更されてしまうといろんな物理量に影響が起こってしまいます。
歴史的には、12C=12を原子量の基準に定義するまでに非常に長い時間を要しましたし、ここまで非常に苦労したのです。この歴史を感じることができる問題が入試問題に出ます。
しかも厄介なことにこれが入試問題に登場するんですよ。
アボガドロ数が2倍になり、1molが6.02×1023×2個になってしまうのです。すると、様々なところで影響が出ますよね。当然アボガドロ数は、12.04×1023個/molになりますし、モル濃度は普段の半分になります。
モルが関わる単位は全て影響を受けます。しかし、モル濃度は半分になり、分子量は2倍になる、などといちいち覚えてもいられないですよね。
これには、受験テクニックがあります。いや、本当は完璧に理解したほうがいいんですし、毎回毎回ちゃんと定義を辿ったほうがいいんですが、めちゃくちゃ簡単に解ける裏技があります。これは正真正銘裏技です。せこいです。
モル計算の本質は「迂回」です。
直接求めることができない物理量をモルに変換して迂回して求める。全てのモル計算は
- モル利用
- モル比
だけで解ける
って言われた時にどうしますか? 普通にgから直接圧力って求められますか? 普通求められないんですよ。
このように直接求めることができない物理量を、「モルを利用」して、「モル比」で求めたい物理量のモルを求めて、変換したらいいんですよ。
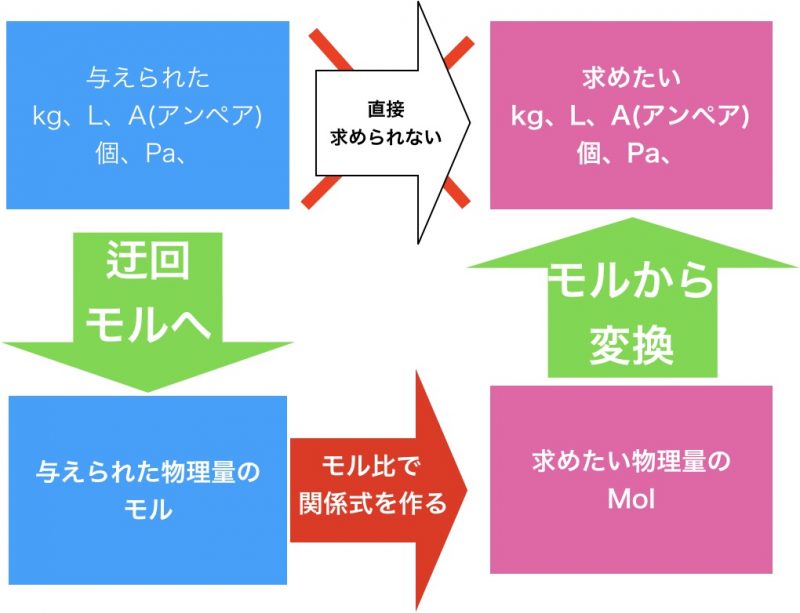
なので、理論化学の計算問題はこの3つのステップだけなんです。
- 一瞬でモルに変換する
- モル比で問題で与えられたものから求めたいものへ変換する
- モルから求めたい物理量に変換する。
モル利用〜最低でもこれだけはモルに0.5秒以内に変換できるようにしろ

モルへの変換の仕方がわかれば、モルからの変換はそれの逆をやればいいんです。これは本当に一瞬でできるようにならないといけません。
| 単位 | 変換方法 |
| g | 原子量、分子量などモル質量で割る |
| Pa | 状態方程式 |
| モル濃度(mol/L) | 体積を掛ける |
| 標準状態体積L° | 22.4で割る |
| A(アンペア) | 秒掛けて96500(ファラデー定数)で割る |
最低限これは覚えておきましょう。
モル比〜それぞれの単元で学べ!
モル比の作り方が各分野の勉強。
理論化学の各分野の勉強っていうのは、モル比を学んでいると考えてください。
例えば、酸塩基でしたら、
酸が投げるH+mol=塩基が投げるOH-mol(アレニウスの定義)
ですよね。
酸化還元だったら、
還元剤が投げる電子のmol=酸化剤が受け取る電子のmol
これだけ。
理論化学を学習するときは、どのようにしてモル比を作ればいいのか? っていうことを意識しながら
まとめ
モルは化学の一番の基礎であり、一番重要なところです。
モルの扱いができなければ、理論化学を攻略することは絶対にできないです。絶対です。なので、今日の非常に重要な内容をしっかり頭に入れておいてください。
それでは!














