こんにちは、なかむらです。
今日は、高校化学でよく言われている、
「似た者同士よく溶ける」
についてです。
この格言は物質の溶解性に関してとても的を射た格言でとても分かりやすいです。
しかし、
「なんで似た者同士はよく溶けるんだろう?」
と思った事はありませんか?
俺は思っていました。そもそも「似た者同士ってなにが似てるの?」と思っていました。
やはりこの理由について分かっていないと単なる暗記に終わってしまいますし、
そしてこの理由は、あらゆる有機反応の原因となっている性質なので、
ここでマスターしておくと有機反応でもつかえ、有機反応を理解して覚える事ができます。なので必ず最後までこの記事を読んでください。
目次
何が似ているの?
この疑問の答えがなぜ似た者同士はよく溶けると言われるかの理由となります。
何が似ているか?というと、その分子の極性です。
つまり、電荷の偏りが存在しているかどうか?ということです。
「電荷が偏っている物には電荷が偏っているものが溶ける。」
「電荷が偏っていない物には電荷が偏っていないものが溶ける。」
と言う事を言っている格言なのです。
極性のある物質同士
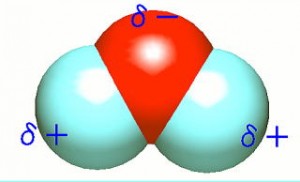
例えば水分子だと。
酸素原子の電気陰性度はフッ素についで原子第2位ですよね。
F>O>N=Cl
このような順番でした。
なので酸素に電子が引き寄せられて、酸素がマイナスに電荷が偏り水素がプラスに電荷が偏ります。
このような「極性をもった溶媒」である水によく溶けるのは、似た者である「極性をもった物質」なのです。
だから思いつく水によく溶ける物質を思い出してください。
アンモニアは電気陰性度が大きい窒素分子に共有電子対を吸い上げられて、極性が生まれていますよね。
このように極性がある水に溶ける物は極性がある物質なのです。
金属でもそのままでは溶けませんが、イオン化すると溶けます。
そもそもイオン化とは、電気的中性物質が電荷の偏りを持つ事を言いますから、イオン化すると水に溶けます。
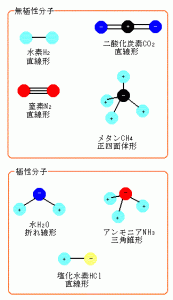
無極性物質
無極性物質は主に有機溶媒と言われる物です。
有機物質の主な原子は炭素と水素ですよね!
先ほどはFやOがHよりかなり大きい電気陰性度をようして、Hとの共有電子対を引き寄せ極性が生まれていました。
この画像から、水素と0.4しか変わらないのです。つまり、非共有電子対を圧倒的に引き寄せるほどの力は無いのです。よって無極性分子となります。
でも、CO2とかって極性が生じてもおかしくないのに、学校では無極性分子って習いました!どういうことなんですか?
まとめ
極性を持つ物同士、極性を持たないもの同士が溶け合います。それは電気陰性度の差が大きいほど水に溶けやすくなります。
[quads id=5]






















ありがとうございます。極性分子どうしが溶けやすいのはわかりました。電気的に引っ張ってるんですよ根。でも、無極性分子どうしが溶けやすいのはなぜですか?なにか力が働いているのですか?
こちらご覧あれ
無極性分子が無極性溶媒に溶ける理由とは?
「極性を持たないもの同士が溶け合います」は、標語的に暗記するのですね!