こんにちは。
芳香族を少しずつ学んで来たため、ここで分液ロート(分液漏斗)を使って、芳香族を分離していく問題を話していこうと思います。
混合物の分離では、多くの人が知っている方法としては、
・沸点の差を使った蒸留
・溶解度の差を使った再結晶
などが思い当たると思います。これ以外の方法があります。
もう問題演習を積んでいる人はこういうフローチャートを見た事があると思います。
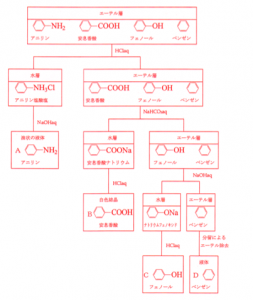
それが有機物の溶解性の違いを用いた『抽出法』と言う物です。
この問題はセンター試験でメチャクチャよく出ます。というわけでこの問題は非常に重要なので徹底的に学んで行きましょう!
目次
似た者同士よく溶けると言う格言
化学には似た者同士よく溶けると言う格言があります。
「なぜ「似た者同士よく溶ける」と言われる?その理由を解説」
つまり、極性を持った物同士(イオンと水)や無極性同士(ベンゼンやジエチルエーテル)は混ざり合いやすいです。
で、今回は、芳香族を分離するわけです。芳香族は無極性なので、極性のある水には溶けず、無極性のジエチルエーテルのような有機溶媒によく溶けます。
しかし、芳香族化合物が何らかの反応によって、『イオン化』した場合、極性を持ちます。
ということで、水に溶解します!
この性質を使って分液ロート(分液ろうと)で芳香族を分離します。
抽出
抽出っていうのは、まあ何となくわかると思うけど、欲しい物を取り出すって言う意味です。
そう、混合物から、欲しい物質を取り出す事を抽出と言います。
複数の芳香族化合物の混合物を
2 水に溶かし、
3 残りを有機溶媒に溶かして分離抽出する!
この手順で分離していきます
分液ロートの使い方
分液ロートはこのような装置です。

このように、水と有機溶媒は混ざり合わないため、水層と有機溶媒は別れています。
また、水より有機溶媒の方が密度が小さいため、有機溶媒が上、水槽が下という位置関係になります。
分液漏斗は、下にコックがあります。というとで、最終的に取り出すときは、下の層が取り除かれます。
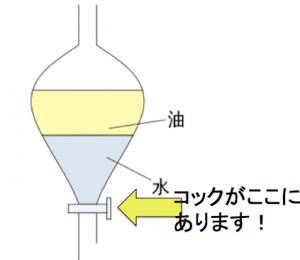
分液ロートないでは、水が下、有機溶媒が上です。
有機溶媒はジエチルエーテルなどをよく使います。
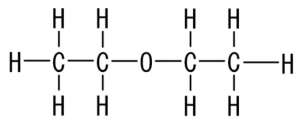
このジエチルエーテルなどは、水よりも密度が小さいため、水に浮かびます。
油が水に浮いているのと同じです。
というわけで、下が水にあるわけです。
で、初期状態は、芳香族化合物が有機溶媒にあるわけです。(芳香族は水に溶けないので)
目的の1つの物質を取り出すためには、まず水層に分離すればいいのです。
そしたら、コック開いて水を取り出せば良いから!
ということで、
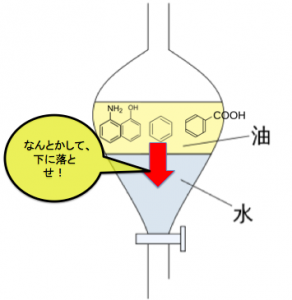
このような状態から一個ずつ、水槽におろしてくる事を目標にして有機溶媒から水槽に移す方法の3パターンを解説していきます!!
アニリンを水層へ追いやる方法
まず、アニリンを水層へ追いやります。
水層へ追いやる方法ですが、
これは中和を使います。
アニリンにHClを加えると、
塩化アニリニウム(アニリン塩酸塩)
が塩として出来ます。
塩化アニリニウムは、イオン性物質で、
アニリニウムイオンになって水に
溶けますので、
有機溶媒から水層へ移動します。
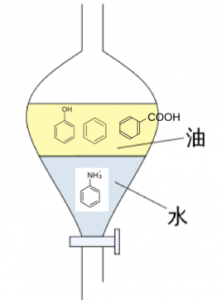

そして、このようにアニリニウムイオンが有機溶媒から、水層へ移動したので、あとは、NaOHなどを使い、弱塩基遊離反応を使って、アニリンを取り出す事が出来ます。
安息香酸を取り出す方法
それではアニリンを取り除いたため、このような状態になっております。

次に安息香酸を取り出します!
「アニリンと同じように考えて、塩基のNaOHをぶっかければええんちゃうの?」
って思いますよね!
でもそれすると、
フェノールもイオン化するで!
そう、フェノールがイオン化してしまうため、分離できないんです。
この理由から、中和して取り出す事は出来ません。
ここで使うのが、弱酸遊離反応です。
有機物の酸の強さの順番ってこういう順番でしたよね。
スルホン酸>カルボン酸>炭酸第1電離>フェノール
スカタンフェノール!で覚えるのでした。
これでスルホン酸は存在しないわけです。てことは、カルボン酸をイオン化するには、カルボン酸より弱い酸性物質の塩を加えれば良いのです!
中和でできる塩は、イオン化します。そしてカルボン酸より弱い塩といえば、NaHCO3しかないわけです!
「あれ?ナトリウムフェノキシドではダメなの?」って思われるかもしれませんが、
フェノールを分離したいと言う問題でナトリウムフェノキシド使うとか、
「いやいや、ナトリウムフェノキシド弱酸遊離してフェノール取り出せや!」って言いたくなりますよね笑
フェノールを取り出す問題で、フェノールを使うのは反則なので、炭酸水素ナトリウムを使います。
C6H5COOH+NaHCO3→C6H5COONa+H2CO3
このように、弱酸遊離反応で炭酸が遊離されて、安息香酸ナトリウムとなり、イオン性なので水に溶けるようになります。
そして、炭酸は、不安定なので、
H2CO3→H2O+CO2
CO2が発生すると言う反応が起きます。
これによって、安息香酸ナトリウムを水層に取り出す事が出来ます。

安息香酸を取り出すためには、弱酸遊離反応で、HClなどで、弱酸遊離反応をすればよいです。
フェノールを取り出す方法
安息香酸を取り出す事が出来たので、後取り出したいのは、フェノールです。
このフェノールを取り出すためには、フェノールをイオン化しなければなりません。
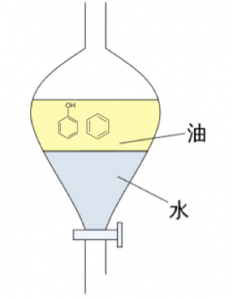
先ほどNaOHを使う事は出来ませんでした。なぜなら、酸性物質が2つあったからです。
ただし、もう大丈夫です。なぜなら安息香酸が既に抽出されたからです。
というわけで思う存分
NaOHをぶっかけましょう!笑
すると、
C6H5OH+NaOH→C6H5ONa+H2O
の反応が起ります。
これにより、ナトリウムフェノキシドが
塩として出来ます。
これはイオン性物質なので、水に溶けます!これで水層へ移動します。
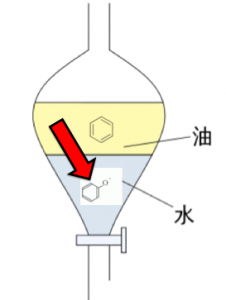
これによってフェノールを抽出する事が出来ました。
ついでにこれもマークしておこう!

このパターンは安息香酸イオンとフェノキシドイオンが水層にあるパターンです。
このパターンは出題頻度はかなり落ちますが、出ない事は無いので、知っておいて損は無いです。
(こう書くと覚えないと!!!と思ってしまうかもしれませんが別にその場で考えてもわかります)
両方イオンなので、どちらかを、エーテル層(有機溶媒)に戻さなければなりません。
で、先ほどの有機物の酸の強さの序列に戻ります。
スルホン酸>カルボン酸>炭酸>フェノール
でした。
この間の炭酸を加えるのです。
でも炭酸は不安定なので、CO2を加える事になります。
CO2を水層にくわえることになります。すると、
H2CO3の炭酸になります。
炭酸は、分子状態です。で、自分より弱酸のフェノールがイオン化しているのです。

もちろん、より強酸の炭酸が、のびたであるフェノールを追い出して分子にしてやります!
すると、フェノールが分子になって有機溶媒に行きます!
そして、水層にある安息香酸ナトリウムを取り出す事が出来ます!
どうでしたか?
これが有機物の分離テクニックです。
このように分離していくのですが、全て考え方を知っていれば恐るるに足らない現象ばかりです。
これを覚えようとするのではなく、毎回キッチリ考えるという姿勢が大事だと思うので、毎回考えましょう!















こんにちは。
何度も失礼致します。
例えばアニリンを抽出する際の事ですが、アニリン塩酸塩ができてからNaOHを加えるのは、他の芳香族との混合物からアニリンだけを取り出すためなので、一度アニリン塩酸塩にしてから NaOHを加えることで、アニリンだったものを、’’アニリンとして‘’取り出すということで良いのでしょうか。
最後に(アニリンの場合)NaOHを加えるということにいまいちピンときていませんでした。
また、CO2を加えてフェノールにするのも同じ理由でしょうか。
よろしくお願いいたします。
ごちゃ混ぜの中からとりだすためにです。
NaOHは弱塩基遊離反応の為に使います。
CO2をくわえるのも弱酸遊離反応です。
ご返信、ありがとうございます。
よく分かりました。
連続でこのような問題を解いていると、直前に解いたものを覚えていて 何も考えずにやっていましたが、この記事は体系的にまとまっているので、毎回きちんと考えてやるのが苦じゃなくなりました。
今後もよろしくお願いします。
ありがとうございます!
これからもよろしくお願いします。
アニリンってアンモニアのように
水に溶けて水酸化物イオンをだすので塩基性をもつのに、
エーテル層でも塩基として塩酸と中和するのですか?
ブレンステッド則でH+を受け取っているのも塩基と言えます。
有機溶媒の選び方についてです。
基本的に、溶媒は水溶性でないという当たり前のことは理解しています。
しかし、
脂肪酸を抽出したいときに、アセトンが溶媒として使えないのはどうしてでしょうか? また、脂肪酸と溶媒の沸点の差が大きくないと脂肪酸が抽出できないのはどうしてでしょうか?(抽出なのに沸点の話が教科書に出ていたので疑問に思いました)
アセトンは極性溶媒なので、水と混合してしまい、二層に分かれることはないので、分液漏斗を用いた抽出には適しません。
脂肪酸とくっくると炭素数によっては話が変わるので、一概には言えませんが、
酢酸などは、水溶性なので有機溶媒には解けません。
抽出で例えば、水層から取り出したとして、単体を取り出すときは弱酸遊離反応を使って有機溶媒へ写してからその目的の物を作ります。
でも、みずによく解ける酢酸ではそれは無理です。そもそも水に解けるのに、例えイオン化したところで溶けますので
フェノールと安息香酸を酸の強さでわける際、炭酸水素ナトリウムだとHCO3-なので炭酸第2電離でフェノールもとけてしまう、ということにはならないのですか?
いや、炭酸イオンならそうですよ。
でも炭酸水素イオンって第1電離だから。
炭酸水素ナトリウムをいれるというのはHCO3-がH+をなげると思っていたのですがそもそもそれが間違っているのですか?
すみません、やっぱりまちがっていました
この場合、炭酸水素ナトリウムをいれることでHCO3-がこれより強酸の安息香酸からH+をうけとるということであってますか?
そうです。
分かりました返信ありがとうございました!
有機溶媒でも水より密度が大きくて、下側にくる例外ってありますか。
仮にあったとしたら、それは高校の範囲ですか?
ハロゲン系はそうですね。
また、高校の範囲です。重要問題集でも出題されている例があります。
ありがとうございます。
なんでハロゲン化されたものは密度が大きくなるのですか、電気陰性度による力とかは関係ありますか?
少しテーマがずれますが、ハロゲンに置換されたベンゼンについて考えてみたんですけど、フッ素に置換された芳香族ってありますか。あるとしたら、水素結合が働いてたりしますか?
長文すいません。