こんにちは。
芳香族で有名な物質というと、フェノールやアニリンなどがありますが、この2つってベンゼンから直接合成できませんよね。
例えば、
フェノールの製法4選!受験生の頭にスッキリ入る原理解説でフェノールの生成反応は書きました。
実は、フェノールとアニリンがベンゼンから直接生成できない理由は同じです。
その辺にも触れながら学んでいきましょう!
目次
アニリンがベンゼンから直接生成できない理由
まずアニリンとは、ベンゼンにアミノ基がついている物の事です。

アニリンの性質とアニリンの反応を徹底的にまとめてみた。でも書きましたが、弱塩基性であり酸化されやすい物質であります。
どうしてベンゼンに直接アミノ基がアタックして作る事が出来ないのでしょうか?
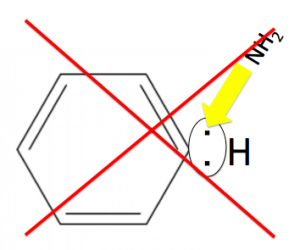
これは、フェノールでも同じですが、
アミノ基は、非共有電子対を持っています。
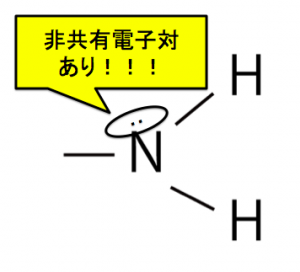
そして、ベンゼンは、
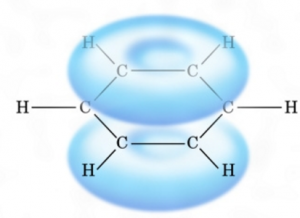
このようにふんわりとした電子の雲が出来ていて、これは電子であるため電荷がマイナスです。
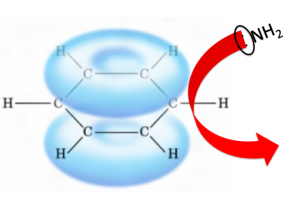
なので、マイナス通しは反発し合う斥力(せきりょく)がはたらくので、アミノ基はベンゼンに攻撃できないわけです。
なので、『ベンゼンを別の物質に変形させ、それをアニリンに変形する』と言う方法を使います。
ベンゼンからアニリンを作る前行程〜ニトロ化〜
まず、ベンゼンからアニリンは作れないので、『ニトロベンゼン』を作ります。
なんでかって言うと、
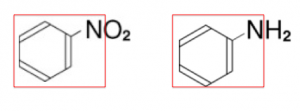
このように、ニトロベンゼンとアニリンは、ベンゼン+Nまだ同じ構造やからです笑。
案外単純ですけど、これ大事です!
なぜなら、ニトロベンゼンとアニリンの違いって、酸素がついてる奴が水素になっているだけです。
そして、酸化物から酸素を取る事をなんて言いました?
還元ですよね!
そして、水素がくっつく事をなんと言いました?
還元ですよね!
せやねん!還元したったらええねん!!
ということで、まずニトロベンゼンをつくります。

ニトロ化は、濃硝酸と濃硫酸をまぜて60℃程度で反応をさせます。
ニトロ化スルホン化とは?触媒が濃硫酸である理由とは?という記事でも書きましたが、濃硫酸は脱水剤の役割で混ざって居ます。
これは、ベンゼン環にアタックできる陽イオンを作るために濃硫酸が使われています。
そして、60℃なのは、『ニトロ化合物』の性質があります。
ニトロ系って、爆薬に使われるわけです。
なかむらが小学校のときとかのゲームで知らない人が多いと思いますが、

こういうクラッシュバンディクーと言うゲームで「ニトロ」と書いてある箱は爆弾でしたね!(知らんか笑)
まあニトロは爆発します。だから、温度を温めすぎると良くない反応が起ります。
なので、60℃程度でした。
これでニトロベンゼンが出来ました。(ここまでは詳しくはニトロ化の記事で!)
ニトロベンゼンを還元してアニリンにする。
では、さっきいってたニトロベンゼンをアニリンに還元していこう!
で、還元剤やけども、「アニリン」は工業的に作るには、なるべくコストを抑えたいわけです。
てことは、安くていっぱいある物が良い。
ということから、Sn(スズ)やFe(鉄)が使われます。
スズは、Sn→Sn4++4e–という還元剤としての反応を起こします。
そして、ニトロベンゼンが酸化剤として働きます。
でも、多くの酸化剤、過マンガン酸カリウムや二クロム酸カリウムなどが酸化剤として働くときに酸性条件が必要でした。
これと同じで、実はこれも酸性条件が必要なのです。というわけで、今回は、HCl条件が必要になります。
そして、このようにHCl条件にすると、どうなるか?出来たアニリンは「弱塩基性」ですので、速攻中和されます。
ということで、ニトロベンゼンが還元された後は、アニリン塩酸塩になります。ということから、ニトロベンゼンの酸化剤としての半反応式が作れます!
ステップ①反応物から生成物
C6H5NO2→C6H5NH3+
とわかります。
ステップ②Oの数を整える
Oの数を整えるときは、Oの数が少ない方にH2Oをくわえましたね。
ということで、
C6H5NO2→C6H5NH3++2H2O
ステップ③Hの数を整える
Hの数を整えるときは、Hの数が少ない方にH+を加えます。
C6H5NO2+7H+→C6H5NH3++2H2O
ステップ④電荷を整える
左辺と右辺で電荷が大きい方に電子を加えて両辺同じ電荷にします。
C6H5NO2+7H++6e–→C6H5NH3++2H2O
左辺が+6分電荷が大きかったので左辺に+6e–しました。
このようになります。
これをまとめて
2C6H5NO2+3Sn+14H+→2C6H5NH3++4H2O+3Sn4+
となります。
これに両辺Cl–をくわえて、化学反応式を完成させます。
2C6H5NO2+3Sn+14HCl→2C6H5NH3Cl+4H2O+3SnCl4
となります。
このようにしてなんとか塩化アニリニウム(アニリン塩酸塩)をつくります。
アニリン塩酸塩からアニリンを遊離
ここまで来ると、アニリンまではもう一歩!
アニリンは弱塩基なのに、塩化アニリニウム(アニリン塩酸塩)として水溶液中でイオン化しているのです。
これは強塩基からしたら許せない事です。
なので、弱塩基遊離反応を使えば、アニリンを取り出す事は出来ます!
C6H5NH3Cl(弱塩基がイオン化)+NaOH(強塩基は分子)
→C6H5NH2(弱塩基が分子に)+NaCl(強塩基がイオン化)
このような反応が起こり、
アニリンの分子を手に入れる事が出来ます!
まとめ
ベンゼンから直接アニリンを合成する事はできないので、まずはニトロベンゼンを経由する。
そして、ニトロベンゼンをSnで還元して塩化アニリニウムを合成し、弱塩基遊離反応を使って、アニリンを取り出します。
このように、なかなかさまざまなステップを経てアニリンに至って居ります。
キッチリ理解するためには、やはり、酸化還元の知識も必要でした。有機に必要な理論化学、化学基礎の知識をまとめた物をテキストにしてあるので、コチラから無料で受け取ってみてください。














酸化還元の反応式でアニリン塩酸塩が導ける事に驚きです。教科書や資料にニトロベンゼンを還元する、と書いてあっても何をどう還元しているのかがイマイチ分からなかったので、とても参考になりました。
ワタナベ先生の詳しく教えてくれる授業にいつも助けられています。これからもよろしくお願いします。
はい!これからもよろしくお願いしますね!
酸性条件にするために塩酸を用いる代わりに硝酸や硫酸を用いても良いのでしょうか?
アニリン塩酸塩を作りたいので、塩酸以外を作る必要がないと思われます。実際に使ってどうなるかはわかりませんが、硝酸は酸化剤なのでスズと反応してしまってよろしくないと思います。