こんにちは。
今日は、ベンゼン環の置換反応の最後の物です。
「置換反応やのになんで付加やねん!」
っておもいますよね。
これもあとで、説明していきます!
これは有名なフェノールの製法に使われる、クメン等を作るための方法です。
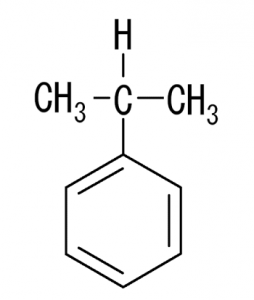
ここからフェノールが生成されていきます。
また、この反応はなんと触媒が『濃硫酸』!
なんで『付加反応』やのに濃硫酸なのか、それもキッチリスッキリわかるようになるんで、安心してください!
目次
付加反応と言うのは?

どうして置換反応なのに付加反応というのでしょうか?
それは、『ベンゼンが付加』するからなんです。

このようにプロペンに対してベンゼンが、付加反応をするのです。
そして出来上がるのが、クメンです。

このようにクメンが出来ます。
ここからクメン法へと繋がっていきます。
クメンからフェノールを生成するクメン法はこちら
そして、これは付加反応なので、もちろん『マルコフニコフ則』が適用されます。

マルコフニコフ則とは、「Hが多い方へ、Hが結合する」というものです。
で、この反応でなぜ、『濃硫酸』を使うのか、という疑問が湧きますよね。
実は、こういう単純に付加反応であると覚えても、これはわからないのです。
難しいと思う人は、濃硫酸が触媒で付加反応すると無理矢理覚えても良いですが、ちゃんとスッキリ理解して、きちんとマスターしたい。
そういう人は、下の内容を理解してください。
ベンゼン環に置換できるのは?

ベンゼン環に置換できるのは、陽イオンですよね。
なぜなら、このようにベンゼン環は、
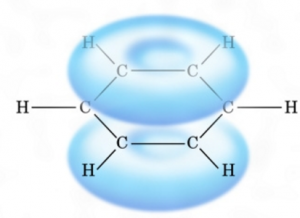
π電子が共鳴しているからです。マイナスが帯びているから陰イオンは近づけないし、ラジカルはこのπ電子を攻撃してしまいます。
有機反応の基本、陽イオン、ラジカル、陰イオンはこちらで説明しています。
有機化学の反応は実は3パターン?結合と再生で考える3つの反応様式!
ラジカルが攻撃するのは、付加反応でした。
ベンゼン環をぶちこわしていく反応でした。
なので、この場合置換反応をするためには、陽イオンが攻撃する反応しかありません。
なので、このようなアルケンから、『陽イオン』を作らないとあかんわけですわ。
アルケンから陽イオンを作る方法

アルケンから陽イオンをつくるときは、濃硫酸を使います。
実は、アルケンに対してハロゲンが付加する反応もこれと同じなんです。
(該当部分です)
X:Xを陽イオンと陰イオンに斬って陽イオンがアタックしていくと言う反応です。
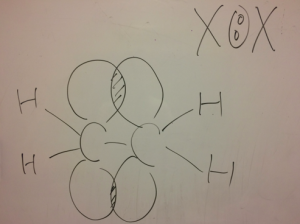
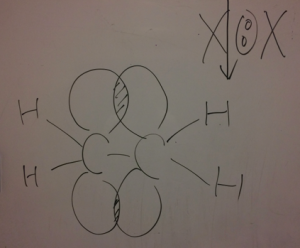

この後に注目!

アルケンが陽イオンになってますよね!
そしてこれに陰イオンがくっつくわけなんですが、

このようにアルケンから陽イオンが出来ていく、流れを応用して陽イオンをつくります。
それは、アルケンへのハロゲン付加の場合は、ハロゲンが、最初にアルケンにくっついていきましたが、
これを濃硫酸の水素イオンでやります。

まずこの状態から濃硫酸が水素イオンをアルケンに対して投げます。

すると、アルケンに水素イオンがくっついて、陽イオンが出来ます。

この陽イオンがベンゼン環のC:Hの共有結合を斬りにいきます。

すると、H+が吹き飛ばされます。このH+が元の硫酸H2SO4に戻ります。

と言う風に置換反応が起ります。
このようにH+を投げるために濃硫酸を使うのです。
濃硫酸は、H+を投げる相手が居なくて、うずうずしていましたよね。脱水剤のところで説明しました。
このようにして、陽イオンを作り置換反応をさせていたのです。
まとめ
この反応は、アルケンへ、ベンゼン環が置換反応が付加する反応と考えても良い。
なので、マルコフニコフ則が適用される。
本質は、
濃硫酸の脱水とほぼ同じメカニズムでアルケンを陽イオンにして置換反応をしている。
だから、濃硫酸が触媒であると言う事が苦もなく覚えられる!!!
というわけです。
このようにちゃんと有機反応を理解すると、簡単に触媒が覚えられたりします。
そのためには、化学基礎、理論化学の基本的な知識が必要になります。
有機反応に必要な知識を学んでいきましょう!
















プロペンに濃硫酸でマルコフニコフに従って付加反応みたいなことをすると、
電子がなくなる部分が3つあるCのはしっこになって、
クメンができなくなりました。。。
ここはどうやって考えているんですか?
すみません
先ほどの質問は勘違いでした。
浅くてすみません
なんどもすいません。
プロペンをベンゼンに置換するために、陽イオン状態にします。
その際、π結合を切るとき、濃硫酸の水素イオンはプロペンの3つの炭素のうち、真ん中の炭素につくのか、端の炭素につくのかはランダム?マルコフニコフ?
マルコフニコフに従い真ん中の炭素に水素イオンがつくと、
クメンになりません。
マルコフニコフがいまいち理解できてません
どういうときに働くのでしょうか?
長々すみませんよろしくお願いいたします!
端っこに付きます。
おそらくマルコフニコフを理解できてないのではないかとおもいます。
水素が多い方に水素が付きます。
真ん中には付きません。
ベンゼンから水素イオンが飛び出す理由と、それが戻ってH2SO4になる理由が分かりません。
硫酸は水素イオンを投げたいならそのまま、HSO4-のままでいたくはないのですか。
投げる相手はいません。水がいませんので