こんにちは。
今日はベンゼンの置換反応の基本とその入試に出る全実例をお話しします。
実は、ベンゼンの置換反応と言うのは、きっちりと共有結合とか電気陰性度、反応の種類を考えると、
なんと、
1パターンしか無いのです!
あとは、ただただ、置換する原子なり、原子団が違うだけ。
本質はたった1つの反応なんです!なので、『クロロ化』『ニトロ化』『スルホン化』とか色々ありますが、
まずは、全部この反応やねんで!ってことをわかった貰おうと思います。
目次
ベンゼン環への置換反応は全て○○!

化学反応と言うのは、簡単に言って、
結合が切れて、結合の組み合わせが変わって再び結合が再生されると言うことでした。
で、この考え方からすると反応と言うのは、
・ラジカル
・陽イオン
・陰イオン
のうちどれかが、結合を斬りにいく
と言う反応にすべて
分類可能なんです!
詳しくはこちら
そして、ベンゼン環への置換反応は、『陽イオン』がベンゼンの炭素と水素C-Hの間の結合に取って代わりにいくのです。
ベンゼン環は電荷が負の電子雲を帯びている
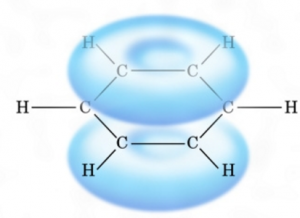
ベンゼン環は、このような負の電子を帯びています。
この青いところ全体が負なんですよ!
てことは、負の電荷である陰イオン
近づけるわけないやん!!!
だから、
『電子を求めて行動する』
(正の電荷を持つ)
陽イオンかラジカルじゃないとダメなんです。
で、ラジカル反応は
どのように置換反応をするのか?
では、どのように置換反応をしていくのでしょうか?
まず陽イオンを生成します!
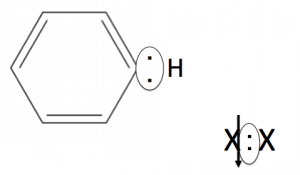
この置換反応の作り方で反応の名前が、『クロロ化』だったり『ニトロ化』だったり細分化されているだけなんです。
そして、陽イオンが共有電子対をアタックしていきます。
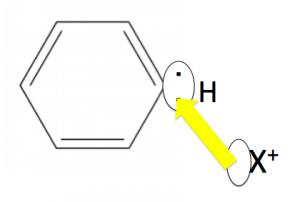
こうするとH+が吹き飛ばされます。
そして吹き飛ばされたH+はX+とくっついていた、X–とくっついたり、触媒に戻ったりします。
実は、ベンゼン環への置換反応というのは、基本的にはこの反応だけなんです。
具体的なベンゼン環への置換反応

ベンゼン環への置換反応というものは、陽イオンの作り方によって変わってきます。
・ニトロ化、スルホン化は同じ分類
・クロロ化、ブロモ化は同じ分類
・アルキル化
とこのような3つの置換反応があり、多くの受験生を悩ましています。
ですが、これらもそれぞれちゃんと理解すれば、スッキリ反応もわかりますし、
有機化学ではかなり重要な触媒も簡単に覚えられます。
「あ、こういう理由でこの触媒を使うんだね!」
ってことがわかります。
なので、確実にこの記事でマスターしておいてください。
ニトロ化、スルホン化
クロロ化、ブロモ化などのハロゲン化
アルキル化
おわりに
いかがでしょうか?
多少難しく感じたなら、
必ず最後の方に、
『脱水縮合と考えても良い』
と言う風に覚え方も書きました。
ですが、ちゃんと理解すると、
『触媒』も簡単に覚えられるんだよ!
ってことが知ってほしかったのです。
以上です。最後までご覧いただきありがとうございました。















コメントを残す