こんにちは。
前回の置換反応でニトロ化とスルホン化を扱いました。
ニトロ化とスルホン化は結果的に、脱水縮合と考えてよかったわけです。
今回のハロゲン化、つまり塩素なら『クロロ化』臭素なら『ブロモ化』になります。
同じタイプの置換反応だったので、ニトロ化とスルホン化は同じ触媒でした。
実は、今回も同じ反応をするため、触媒は同じです。
この触媒も非常に重要なのでそれにも着目しながらご覧下さい。
目次
クロロ化、ブロモ化の肝は鉄触媒

実は、クロロ化ブロモ化の鍵を握っているのは、鉄です。(画像は磁鉄鉱です)
これは、鉄が4配位の錯イオンになりやすい性質があるからです。

このように、鉄は塩素と結合すると、塩化鉄(III)となります。
そして、これだと鉄の周りに配位結合が3つしかありません。
なので、この鉄が4配位の錯イオンになるために、もう1つ塩素を奪ってこないとだめです。
そして、

[Fe(Cl)4]–になります。
この性質を使って、クロロ化ブロモ化をしていきます。さあどのように反応していくのか見物ですね。
クロロ化
まずクロロ化ですが、触媒は、Feまたは、FeCl3を使います。
ベンゼン環と塩素が反応するので、Feでも、Cl2と反応してFeCl3でも触媒として使えます。
FeCl3とCl2があります。
そして、このFeCl3がCl2から塩素の陰イオンを捕まえます。

すると、塩素の陽イオンができます。
2Fe+3Cl2→2FeCl3でFeCl3が生成されます!
ベンゼン環は、下のように電子がまとわりついていて、
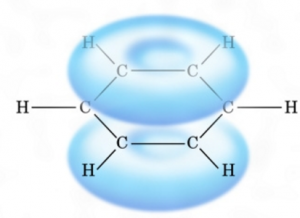
陽イオンまたは、ラジカルしか攻撃できません。
ということから、陽イオンになるというのは、非常に良い状態です。
この陽イオンが、ベンゼン環のC-H結合にアタックしていきます。
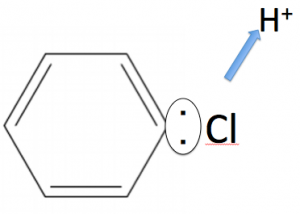
このようにして、H+を吹き飛ばす事によって、クロロベンゼンになります。
で、このH+がさきほどの[FeCl4]–からClを奪って、HClになります。

このような流れで、クロロベンゼンが出来ます。

ブロモ化
このブロモ化もクロロ化と同じ反応をします。
臭化鉄(III)FeBr3が触媒になります。
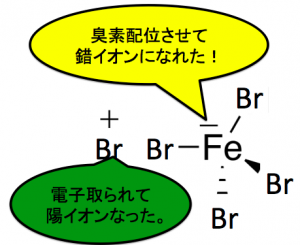
この臭化鉄(III)がBr2からBr–を奪って、[FeBr4]–になります。
このBr+がベンゼン環にアタックします。すると、H+を吹き飛ばしてブロモベンゼンになります。
2Fe+3Br2→2FeBr3から、FeBr3が出来ます。
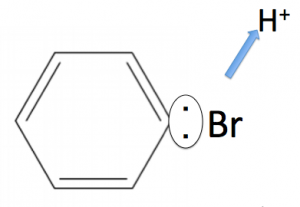
このようにH+を吹き飛ばしていきます。これにより、ブロモベンゼンが出来上がります。

そして、余ったH+が[FeBr4]–からBr–を奪って、HBrになります。
いかがでしょうか?ニトロ化、スルホン化とは異なる置換反応が起ります。
このように、陽イオンがアタックしていくこの反応の流れを抑えておいてください!
それではありがとうございました!















ハロゲン化でクロロ化やブロモ化はよく見るのに、
Fの置換(フルオロ化?)はあまり聞きませんがなぜですか?
その辺はよくわかりませんが、あるとは思いますよ。想像ですが、フッ素の電気陰性度が大きすぎてフッ素の陽イオンが作るのが困難だからだと思います。
なるほどですね!
ありがとうございます!
鉄が4価の錯イオンになりやすいというのはどういうことですか?鉄は2または3価を取りやすいと思うのですが。。。Cl4の4のことかなとも思ったのですが、このとき鉄は4価になったというのですか?
コメントありがとうございます。
すみません。4配位でしたね。
クロロベンゼンがさらにクロロ化されてジクロロベンゼンやトリクロロベンゼンになったとき、それぞれすべての異性体が教科書にはのせてあったんですが、このとき配向性は配慮されないのですか?
FeBr4- から H+ が Br- を奪ってHBrになるのはわかったんですけど、
Br- を奪われた FeBr4- はどうなるんですか?
配向性というのは100%そうなるわけではなく、オルトパラならオルトパラになりやすいのです。
100%オルトとパラにしか置換基がつかなくなるわけではないです。
鉄の錯イオンの図で点線と三角みたいなやつはなんですか?棒となんか違うんですか?
点線や三角は、立体的な構造を示すものです。
例えば、スマホやpcの画面を紙面と見たときに、紙面の下にあるのが点線で、上にあるのが三角、そして紙面上にあるのが実線、つまり棒と言うわけです。教科書などでは簡略化のためにどうしても平面的に物質を書きますが、実際の物質は立体的に腕を伸ばしていて、それを表現したい時に点線や三角を使います
鉄の配位数は6ではないんですか?
場合によりけり
クロロ化において、ベンゼンから追い出されたH+が[FeCl4]–からClを奪って、HClになるというのはなぜですか?
ベンゼンに置換反応を起こすのは非金属の陽イオンだけなんでしょうか?金属の陽イオンも置換を起こせないのかなと考えてしまいました・・・
陽イオンになっている理由が違います。
金属は陽イオンになりたくてなっている=電気陰性度が小さくそれほど電子が好きじゃない。
非金属の陽イオンは陽イオンに無理やりされた=電気陰性度が大きく電子が好き。
ベンゼンの置換反応の本質は「電子を求める反応」ですから、非金属の方が置換しやすいです。
もちろん100%例外がないかというとあるとは思いますが、、、