もし、
「なかむらさん!有機で一番大事な官能基って
なんですか?」
と聞かれたら、
カルボニル基に決まっとんだろうがよぉおお!!!!
と0.1秒で答えます。
カルボニル基は
入試で頻出の反応に
『ことごとく関わっています。』
例えば、
『 エステル化』『 アミド化』
『けん化』『加水分解』
『 ペプチド結合』『 糖の環化⇔開環』
これらの反応は全て
『カルボニル基』が関わっています。
なので、確実にマスターしていきましょう。
目次
カルボニル基ってなに?

こういうふうに、C=Oがあるもの
のことを言います。
C=Oをもつものは、
『ケトン』、『アルデヒド』
『カルボキシ』などがありますが、
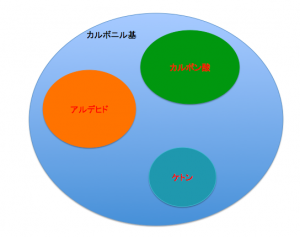
というような包含関係になります。
つまり、本日説明します、
カルボニル基の特性は、これらの
官能基にも適用できます。
まあ、アルデヒドに関しては、
すぐ酸化されてカルボン酸になりますし、
銀鏡反応や、フェーリング反応
の問われ方しかされませんが、、
カルボニル基の極性とは?

これがカルボニル基ですが、
カルボニル基には、
共有電子対を引っ張る力に
大きな差があります。
共有電子対を引っ張る力のことを
『電気陰性度』と言います。
この電気陰性度の大きい順番で
覚えておかなければならない順番を
示すと、
F>O>N= Cl>・・・>C
ほん とに くるよ合格通知
この語呂で覚えてください。
そして、OはCより電気陰性度が
大きいです。
ということは、OはCとの共有電子対を
自分の方へ引っ張っていきます。
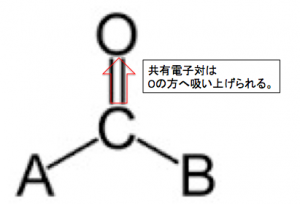
すると、
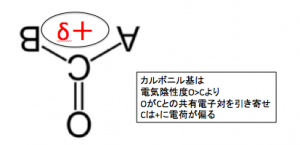
CはOに電子を取られてδ+の
電荷の正への偏りが生じます。
実は、これが有機化学のかなりの反応に
影響を与えることになるとは、
誰も知る由もなかった、、、、
超重要『男女のエッチな反応』
電荷が正に偏るということは、
電子が取られた分の『穴』が出来ると
とらえられます。
電子が足りなくて出来た穴を埋めるのは、
そりゃ『電子でしょ!』
まるで男女のあの行為のように、、、

様子を見てみましょう!
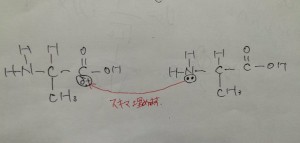
男女の愛の反応の様子

このようなヒドロキシ基のような
『 非共有電子対』を持っている
官能基が電子の『穴』に
アタックします!!
C「あ〜、今まで私のアソコを埋めてた電子を
取られて寂しいわ、、、」
(Cにも穴が出来ているのです。)
O「俺が、お前の穴を埋めたるで!」
スキマ埋めます、、、、
ちょっとHな話になってしまいましたが笑
「電子を取られた、炭素の心の穴に付け入ってヒドロキシの酸素が炭素と結合する。」
と言う風に覚えてください!
また、ヒドロキシ基だけでなく、『 アミノ基』にもティンコ非共有電子対があるので、

アミノ基も『ティンコ挿入』反応が出来ます。
ティンコ挿入反応を使う反応たち
このように非共有電子対を正の偏りに挿入する反応は結構たくさんあり、この反応を覚えればかなりの反応を覚えやすくなるのです。
だからこそ最重要と言っているわけです。これを理解したら、有機反応の8割を理解したと言っても過言、、、
ではありますが、笑まあまあ理解したと
思っていいです!
エステル化
エステル化はカルボン酸とアルコールが反応してエステルが出来ると習っていると思います。しかし、これも実は、男女の夜の営み反応なのです。
ひとまず、エステル化の性質に関してこちらの記事で激しく詳しく説明しました。
この記事のように反応を覚えると、エステルのCOOのOはカルボン酸のOなのか?アルコールのOなのか?みたいな愚かな疑問も湧かなくなります。
電子を使った反応の理解なので、かなりスッキリ覚えられます。
丸暗記にはなりません。
エステルの加水分解・けん化
エステルを加水分解する、また、この反応を最強にしたけん化も加水分解の一種と言えます。ちなみにこれに関しても先程の記事に詳しく書きました。
実は、エステルの加水分解もエステル化と全く一緒で、今日話したカルボニル基への男女の夜の営み反応の一種なのです。本当に見事に一緒です。みんな夜の営みが好きなのです。
人間と一緒です。

エステルの加水分解も水の酸素原子の非共有電子対をカルボニルの穴に挿入したものです。
アミド化・ペプチド結合
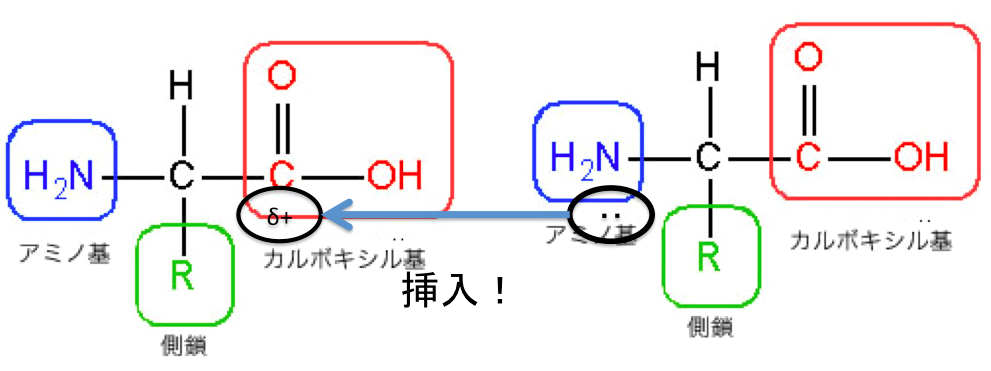
アミド化もペプチド結合も一緒のことを意味しています。
ペプチド結合は、
アミノ酸同士のアミド結合のことを
言います。
これはアラニンというアミノ酸同士の
結合を表しています。
アミノ酸のアミノ基がカルボキシ基に
アタックしています。

そして、このように、結合します。
この青枠の結合を、
『アミド結合』といい、
アミノ酸同士の場合は
『ペプチド結合』ですよね。
まあ、簡単に言うとこれまでの夜の営み反応は、ティンコがヒドロキシ基の非共有電子対だったけども、今回の反応はティンコがアミノ基の非共有電子対になっただけである。
あまり難しい話でもないけど、学校では語られない反応のことを公開した。
大学ではもっと詳しく習うけど、受験レベルではこのくらいの理解で十分すぎるほどです!
此所まで分かれば構造決定で自分で考える力がついてきます。始めてみた問題でもきっちり解けるようにしていきましょう!
それでは!
(このまま下にいくといいことがあるよ。)














けん化の話で、なぜNaOHを使うと不可逆なのかがわかりません(××)教えてください!
NaOHは完全電離します。
だからOHのスキマ埋めます反応が
起りやすいのです。
反応とは衝突です。
水は、H2O⇄H++OH–
の反応が殆ど起らない。
なぜなら中性だから。
だから衝突の回数が少ないのです。
けん化でカルボン酸側のOHはそのままとれるのに、
アルコールのOHがOとHに分かれるのはなんでですか?
RCOORのところも、どうしてRCOとORに分かれるんですか?
結合によって、電気的に偏りが生じてたとこが切れるんですか?
アホっぽい質問ですみません
教えてください
あと、水が中性だから反応が起きないのとこもわからないです
まず、カルボン酸の、>C=Oの部分、このCは周りのOからかなり電子を引っ張られて、電荷が偏っています。
そこに-OHのOの非共有電子対が
Cの電荷の偏りを埋めに来ます。
するとこの-OHのOが
怒ります。
-OHのO「なんで俺がプラスとくっつかなあかんねん」
Oは電気陰性度大です。
だから、正とくっつきたくはないのです。
で、くっついてしまったため、
-OHはHから共有電子対を
ひっぱります。
そこでH+が
取れます。
どうように-COOHのOHの
非共有電子対に
H+が
くっつき、Oが怒ります。
その後、OがCから非共有電子対を
奪って、
H2Oとして抜け落ちます。
ちょっと文字ではわかりにくいかも
知れませんがこういう感じです。
ヨードホルム反応等の反応機構についての記事を書いて欲しいです。
反応機構とまではいきませんが、
かなり詳しく反応の流れ、
そして、反応式の立て方まで
書かれている記事はあります。
ヨードホルム反応、反応式の作り方!構造決定利用法を公開!!
高2で有機化学まだやって無いですが、めちゃくちゃわかりやすかったです。
ありがとうございます!
未習なのにスゴいですね!
水酸化カルシウムって水に少ししか溶けないんですか?
沈殿パターンのところを見直してください。
沈殿のあたり
アセトンは炭素が3つあるのに何故アセトがつくのでしょうか、
降りてきた
化学はこのサイトにお世話になりまくっているのですが、今までエステル化などの反応も、δ+がδ-に非共有電子対を突っ込む!!とか見ても『あーまたおせっせね?いやよくわっかんねっけどくっつけてCOOでしょ?』と毎回記事を読んでは首をひねっていたのですが、
今日、見えました。(多分)完璧に理解しました。ケトン基すげえっす。ついでに一緒に開いてたジアゾ化の話も理解しました。p位ね。そりゃそうだ、と。もう少し早かったら有機の理解度を完璧にできた状態で受験に臨めただろうに・・・。
まだ間に合う!
(コメント暴発・・・)
理解した、とか言ったくせに質問なのですが、
FやClで電荷の偏りδ+が生じていますか?見かけないのですが・・・