こんにちは。
高分子ではない、低分子の有機化学はここまで来ると残りわずかですね!
というわけで、ベンゼン環の反応で、置換反応の一種のニトロ化とスルホン化についてお話ししていきます。
目次
なぜベンゼンは置換反応の方が起りやすい?

脂肪族の反応では、付加反応の方が、置換反応より起りやすかったですよね?
なぜなら二重結合の二本目の結合、すなわちπ結合を切って付け加わる付加反応の方が、σ結合を切って置き換わる置換反応より楽に起るからです。
でも、ベンゼンは違いました。
なぜなら、ベンゼンの場合は、π結合がみんなで一致団結して共鳴するからです。
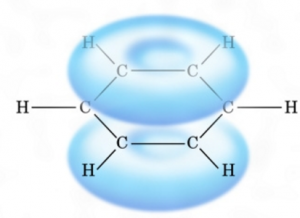
こういう状態になるわけです。
こういう状態になるわけですから、付加反応がメチャクチャ起りにくくなるわけです。
そして、この置換反応の代表格として、ニトロ化とスルホン化があります。
この2つの反応には、共通点があります。それが濃硫酸を使うと言うことです。
濃硫酸と言えば、脱水剤として使われていました。
そう、実は、ニトロ化とスルホン化で起っている事って言うのは、脱水なのです!
これがわかっている事で、ニトロ化、スルホン化の触媒が濃硫酸である事が楽勝でわかるので、このニトロ化とスルホン化のメカニズムを完璧に理解しておいてください!
ニトロ化のメカニズム
実はニトロ化のメカニズムはほとんど脱水と同じなのです。
脱水と言うのは、OHに対して濃硫酸がH+を投げる事によって、H2Oが抜ける事でした。
流れについては、脱水剤関連のテキストを読んでください。
この脱水が、硝酸でも起ります。
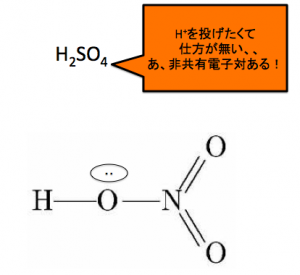
まず硫酸がいつもの脱水のように、H+を投げたがっています。すると、非共有電子対の存在に気付きます。

それに向けてH+を投げつけていきます。

電子が大好きなOが陽イオンを受け取ると言うのは、ありえないことです。なので直ちにNから電子を奪います。

すると、H2Oがとれて、このような陽イオンになります。これがベンゼンに置換しにいきます!
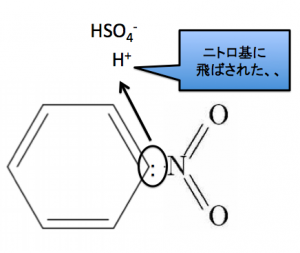
そしてベンゼン環のH+を吹き飛ばす事で、濃硫酸は触媒のままで居られるのです。
ま、こういうメカニズムを知れば、なぜ濃硫酸を使うのか?というのがよくわかるのですが、
このように水が取れて、脱水縮合すると覚えても良いです。

どちらにせよ硝酸の構造式は重要なので覚えておいてください。
また、ニトロ化は、60℃の温度条件で行います!
その理由は、

ニトロ系の物質は爆薬として使われます。あまりに温度が高いと爆発します、、、、
なので、あげすぎない60℃位にしておかなければなりません。
スルホン化のメカニズム
スルホン化も同じメカニズムで起ります。

脱水剤の硫酸が相手が居ないから、硫酸に投げつけます。
でもOは陽イオンが嫌いで電子が好きですよね。
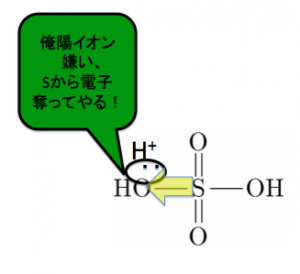
そしてSから電子を奪い、Sから水がとれます。
そして陽イオンになって、ベンゼンにアタックしていきます。
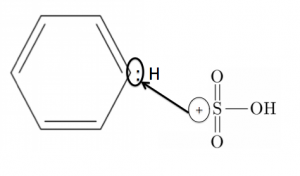
そして、置換します。

このようにスルホン化されます。
このようにメカニズムはニトロ化と全く同じです。
なので、このスルホン化も先ほどと同様に脱水縮合と考える事が出来ます。
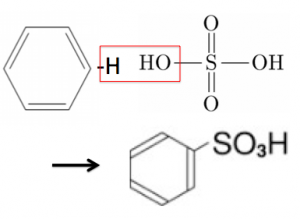
このようにしてベンゼンスルホン酸になります。
[quads id=6]いかがでしたか?
ベンゼンスルホン酸もニトロベンゼンも同じメカニズムで出来ている事がわかれば、
触媒がよりいっそう覚えやすかったですよね。しかもこの反応は既に、アルコールのところで既に習っています。
有機反応はいかに過去に習った反応とリンクさせるかです。
それが出来るのは、化学基礎、理論化学の知識があるからです。
まずは有機に必要な理論化学の知識を身につけましょう!















少ない原理で多くの反応を説明できますね。頭がスッキリしました。ありがとうございます
ありがとうございます!
かなり高度になってきますが、理解重視で行きたいと思います!
そもそも論なんですが、なぜ硝酸の構造式が上記のようになるのでしょうか?
窒素の価標って3本じゃありませんでしたか?
配位結合です。
どうしてベンゼンのHは飛ばされるのでしょうか?
ニトロ化の際に硫酸も使っているのだから、スルホン化も主反応ではないにしろ起こっていたりしませんか?
問題などでも、混酸を入れた時の生成物を答えよみたいなのだとやはりニトロベンゼンしか答えにはありませんでした。
ふと疑問に思ったので質問させていただきました。
どうしてベンゼンスルホン酸は酸性なんですか?
H+を投げるからです