こんにちは。
硫酸、塩酸、硝酸、数々の強酸があります。また、酸化力のある酸は、熱濃硫酸など、
色々あります。

でも、なんで濃硫酸が、脱水剤に使われるんだろう、
と思いませんか?
しかもなぜ硝酸ではダメ?
なぜ塩酸ではダメ?
そう思いますよね。なので、なぜ脱水剤として濃硫酸が使われるのか、ということを完全解説していこうと思います。
目次
濃硫酸とはなにか?考えてみる
まず、濃硫酸の性質を知ることで、なぜ濃硫酸が使われるかを考えて行きましょう!濃硫酸は、まず、メチャクチャ濃いです。
98%なんですよ。

満員電車のように、溶液中にほとんどが濃硫酸が占めているわけです。そして、硫酸は強酸でした。強酸と言う事は、電離定数が大きいのでした。
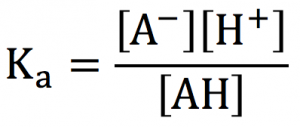
簡単に言うと、H+を投げる力がメチャクチャデカいので、バンバン投げます!
でも、
濃硫酸って
投げる相手居ますか?
だって、H2SO4はおたがに投げたいと思っているのに、投げる相手が居ません。
(※相手が居なさすぎて硫酸が硫酸にH+を投げる反応があり、それがスルホン化です。)
これが希硫酸だと、H2SO4以外に、H2Oもいっぱいあります。
だから、H2SO4が、H2OにH+を投げる事ができるわけです。H2+H+→H3O+の反応が起ります。
これを理解しておくと、非常に濃硫酸の脱水がよくわかります!
脱水のメカニズム
脱水のメカニズムは、濃硫酸がH+をぶん投げること、によって起るわけです。
脱水のメカニズムは、濃硫酸の投げたくてうずうずダルビッシュを利用するのです。
濃硫酸は、水が無いので、とにかくH+を投げたいのです。これを活かして、脱水をします。
アルコールの脱水
アルコールの脱水反応もこれを使います。アルコールの脱水は、130~140℃程度では分子間脱水が起こり、160~170℃程度では分子内脱水が起こります。
分子間脱水


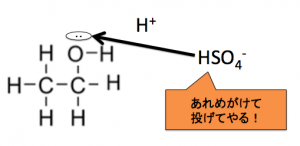


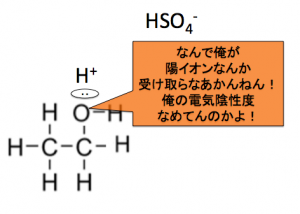
なので、別のエタノールの
-OHのOの非共有電子対が
助けに来てくれるんです!
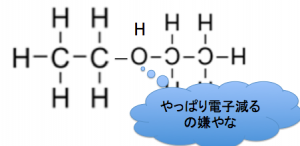
で、非共有電子対を使って助けてくれたOでしたが、
Oって電気陰性度大きい、
なのに、陽イオンを受け取ると、
やっぱりストレスなのです。
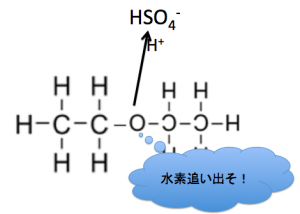
と言う感じで、
水素原子を追い出してしまうんです!
こんな感じでジエチルエーテルが出来ます。
分子内脱水
分子内脱水は、約160~170℃で加熱させます。





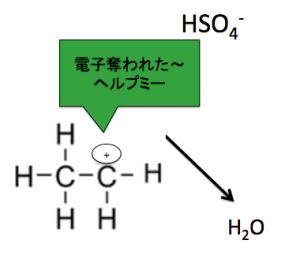
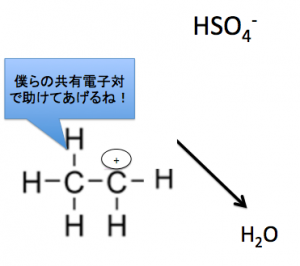

このように、
『非共有電子対』に
水素イオンを投げる事で、
脱水は行われているのです。
また最終的には、必ず、
濃硫酸にH+が戻っていますね。
と言うわけで濃硫酸は、
『触媒』なわけです!
ニトロ化・スルホン化も実は、、
ニトロ化もスルホン化も実は、
この脱水剤濃硫酸を使っています。
先ほどと全く同じ流れで、
脱水し、ニトロ化を促したり、
スルホン化を促したり、
していきます。

このように、硫酸が硝酸に、
H+を投げつけます!
そして水が取れます!

H+を投げつけて、
水がポロんと取れます!

そうすると、ニトロ基です!
これがベンゼン環にアタックして行くのです!
スルホン化は
硫酸が硫酸にH+を投げつけて
脱水する技です!
硫酸分子はこうなります、
-OHはOに非共有電子対
があります。

この非共有電子対に水素イオンH+
を投げつけます。
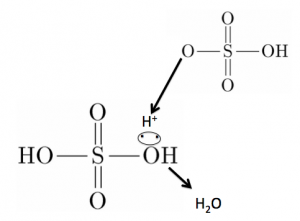
水がポロんと取れます!
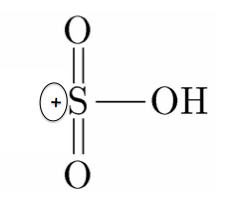
このようにしてスルホン化のためのスルホ基が出来上がるのです。
(※先ほど言った自分自身に投げる反応というのもこれです!)
乾燥と脱水の違いとは?
乾燥と脱水は結構違います!
この2つをキッチリ区別して行きましょう!
乾燥
乾燥とは、ある物質と水の混合物から水を除去する事です。
脱水
脱水は、分子中から
H2Oと言う分子式を
抜く事です!
なぜHClやHNO3が脱水剤に使われないの?
実は、これはよく考えたら、揮発性酸遊離反応とかと理由が大きく異なりません。
上の記事でも書きましたが、揮発性酸遊離反応でも言いましたが、HClやHNO3は常温で気体ですよね!
でH2SO4は液体なわけです。
じゃあ、もし98%の塩化水素溶液考えて見てくださいよ!
気体やん!
98%の濃硝酸考えてみてください!
気体やん!!
というわけなんです。
もちろん、
濃塩酸も濃硝酸もありますよ。でも濃いといっても98%とかを実現することは出来ません。
でも濃硫酸の濃さはもっとえぐいんですよ!
濃硫酸は常温で液体やから98%の濃硫酸溶液が可能なんです!
と言うわけで、
脱水剤としては濃硫酸がおもに
使われます。
よくある勘違い
よくある勘違いをお答えして
起きます!
濃硫酸はエステル化でも脱水剤として使われますが、酸として働いたりしないのですか?
酸として働いているから、脱水剤なんですよ!
酸じゃないと脱水剤として働けません。だって、さっきから硫酸は、H+を投げまくってましたよね!これってもろ酸の定義ですよね!
だから濃硫酸の脱水作用は、『強酸性』から来る物なんです!
濃硫酸って結構色々な作用を持っています。なので、この用に1個1個学んで行く事が非常に重要ですね!
それではありがとうございました!














ちょっと話違うんですけど
アセトンの製法の(CH3COOH)2Caの乾留ってスキマ埋めます反応ですか?
スキマ埋めますというよりは、
転移反応にちかいですね〜
受験的には熱分解に分類されてしまいます。
https://xn--qck0d2a9as2853cudbqy0lc6cfz4a0e7e.xyz/inorganic/thermolysis#i-7
分子内脱水についてですが
水が取れた時に片方のCが電子が奪われて穴ができて、そこに片方の電子をうめて結合ができるんですか?
単結合(1本)のときの価標ってお互い電子を1個ずつ出し合うんじゃないのかなっていう疑問です
また水が取れる前に、硫酸が投げた水素イオンとOHとOがCから奪った電子がどんなふつうに水になるのかもよくわかりません
あまり細かいことは気にせずイメージだけで、ただ水が取れるって覚えればいいですかね?
それは酸素の電気陰性度がCより大きいからです。
もし、C-Oの結合で、共有電子対が別れてラジカルとなって離れたら、H2O+となりますよね。
こんなことは、アリエナイので両方奪っていきます。だから炭素が陽イオンになります。
>また水が取れる前に、硫酸が投げた水素イオンとOHとOがCから奪った電子がどんなふつうに水になるのかもよくわかりません
どういう質問かよくわかりませんが、
上の説明でわかると思います。
この辺は別に普通に覚えても良いと思います。
濃硫酸は弱酸、
希硫酸は強酸ではないですか?
そうですね。酸としての性質は弱いです。
ですが、H+を投げる力は強いです。
持て余しているだけです。
なので、ポテンシャル的に強いです。だから脱水する事が出来ます。
記事内の硫酸の硫黄原子の手が6本になってるんですがこれは間違いですか?
間違いでないのならばなぜそうなるのか教えてください。手は4本までとしか教わってないので。
そこは配位結合ですが、その結合は電子が流れてπ結合のようになっているためです。高校化学で説明は基本不可能だと思ってください。→で代用されます。
とてもユーモアがあり分かり易いですね
参考になりました
ありがとうございます!
脱水の触媒に濃硫酸が使われる理由が
よくわかりました。
常温で気体で、濃くて水が少なすぎるからH+り投げたい! というのがポイントなんですね。
スルホン化、ニトロ化も、よくわかりました。
流れがわかって、楽しかったです!
セミナーで濃硫酸は少量と書いていたのですが、なぜなのでしょうか?
いつもお世話になっています。面白いし、とても分かりやすいです。
ただ一つ気になるのですが、硝酸って常温で気体なのでしょうか?
Wikipediaをみると液体となっていますし、
三菱ケミカルが通販で98%濃硝酸というのを売っているらしいです。
なかむらさんでは無いですが、同様の疑問を持ちまして、思ったことがあるので返信させていただきます。硫酸は沸点が290℃、硝酸は沸点が82℃です。また、推測ですが分子から水を引っこ抜く訳ですから加熱してエネルギーを高めていないとさすがに取れないのではないかと思うので、100℃(水の沸点)以上にします。少なくともアルコールの場合はそうなっています。この際に硝酸ですと、沸点に達し空気中に出てしまうので硝酸は用いることができないと考えます。塩酸は氷点下で気体なので尚更です。よって(濃)硫酸を用いると思いました。
ありがとうございます。
エステル化において濃硫酸の働きを教えてください
脱水ですね。
エステル化など絶対に押さえておくべきカルボン酸の反応5選!