こんにちは。
今日は糖の勉強では絶対に避けられない『二糖』や『多糖』の勉強に深く関わるところです。
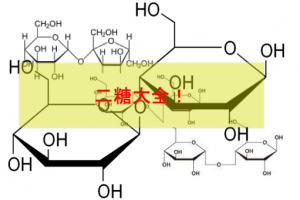
単糖がグリコシド結合をすることで二糖や多糖になります。またグリコシド結合をします。
目次
グリコシド結合とは?
グリコシド結合とは、糖同士を連結する結合で、『アセタール』が出来ます。
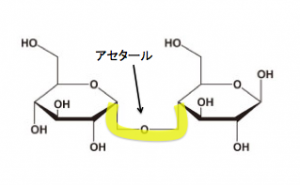
アセタールについては下をご覧下さい!
このようにアセタールが出来ます。
グリコシド結合生成の様子
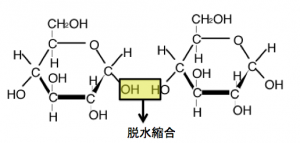
グリコシド結合はアセタールを作るもので、つまりは『エーテル結合』を作る事です。
なので、分子間脱水と同じ反応で出来ます。
なので、まず
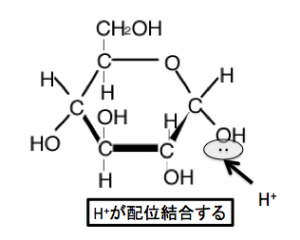
これによってOHがH2Oになります。するとOが「陽イオンなんていらんねん!電子よこせ!」といい
Cからごっそり共有電子対を奪い取ります。するとCが+になります。

そして、この生じた炭素の陽イオンに対して、別の糖の非共有電子対が穴に挿入してくれるのです!
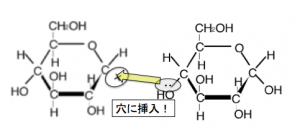
このようなながれでアタックします。このときOの非共有電子対で+を埋めるため、
埋めたOHのOは電子ではなく、陽イオンを受け取った事に怒り、O-H間の共有電子対を全て自分のものとし、H+が飛んでいきます。
これにより二糖類が完成します。

まあ見覚えがある人はわかると思いますが、エステル化とほとんどの同じ反応をしているのです。
なので先ほどのH+をヘミアセタールに投げつけてくるのはもちろん、希硫酸です。エステルと同様加熱は必要です。
必ずヘミアセタールのOHが脱離する
H+が配位結合して、その後H2Oが脱離しますが、このとき脱離するヒドロキシ基は必ずヘミアセタールのOHです。

このようにヘミアセタールのOHが抜けるときは、近くにあるOの非共有電子対がCからOHが抜けたときに、電子が埋めてくれるのです。
「あれ、+がよわまったら反応しにくくなるんじゃないの?」と思われるかもしれませんね。
しかし、これはそもそもOHを脱離する事が難しいのです。
だって、-OHを抜き去るというのは、わざわざ不安定な状態にすると言う事ですよね。
こういうとき『活性化エネルギー』がデカくなるのです!
これより反応が起りにくくなります!
なので、Oが+を電子を埋めやすくすることによって、より安定です。なので、活性化エネルギーが小さいのです。
なのでヘミアセタールからOHが奪われます!
グリコシド結合の加水分解
次は加水分解です。加水分解もこのエーテル結合のOに向けてH+を投げつける反応から始まります。
そしてC+が出来上がるのでそこに水H2Oの非共有電子対が穴に挿入します!

この位置で切れます。その理由は、、、
もちろん先ほどと同じです。

ヘミアセタールのOが近いため、+を埋めてくれるのです。
これによって加水分解する事が出来ます。
まとめ
糖の反応ももはや芳香族までの反応の知識を使えば楽勝である!
糖が苦手だと思っている人は、それよりも
「エステル化」「エステルの加水分解」「分子間脱水」
を学んだ方がいいです!
それではありがとうございました!












楽しく読ませてもらってます。加水分解はいつも適当にどちらかの結合を切ってOHとH付けとけ!とか思っていたので目からうろこと涙が出ました。
仮の状況を想定した場合のご意見を伺えればと思うのですが、
この二糖の加水分解を阻止したいと考えたときに、Oの非共有電子対を使っちゃえばいいと思ったのですが、そういう考え方でよろしいでしょうか。
(Oの共有電子対の使い方とかは良く分かりませんけど、酸とかのH+もってくるか、何かで水素結合させればいいんですかね?)
素人質問ですみませんが、より理解を深めるためと思ってお相手いただけると嬉しいです。
よろしくお願いいたします。