酸塩基は入試で頻出の『中和滴定』がある。ここを入試で得点できるかは今日の記事の内容が身に付いているかにかかってんで!
さあ、気合いを入れて酸塩基の定義を理解していきましょう!
目次
酸塩基には2つ定義がある
酸っぱいのが酸で、苦いのが塩基じゃ無いの〜?
それでもいいかな!
でも僕達は入試問題を解かなくちゃいけないし
大学でも絶対に化学を使うから、
厳密に覚えとかなあかんねん!
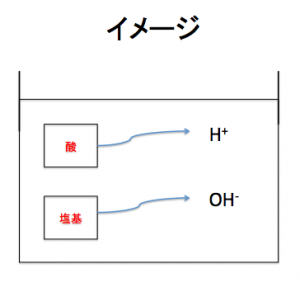
アレニウスの定義

アレニウスさん
これは物質が、水素イオンを投げるか、水酸化物イオンを投げるかで酸か塩基を決めているねん!
酸塩基のイメージ
酸は水素イオンのピッチャー
塩基は水酸化物イオンのピッチャー
って言う風に覚えてくれ!
アレニウスの定義の例外
でもな、超有名な塩基がこのアレニウスの定義で説明できひんねん、
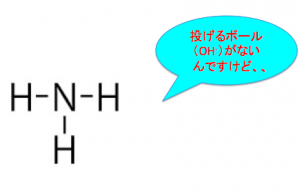
それがアンモニアやねん!
アンモニアには投げるべきボール、つまりOH^-がないのです。
アンモニア
なので、アレニウスの定義では『塩基』では無くなってしまいます。
ですが、アンモニアって普通に塩基ですよね?
そこで、アンモニアが塩基であると言えるように
別の定義が必要になります。
ブレンステッドの定義
酸とは水素イオンH+を反応する相手に与えるものであり、塩基とは水素イオンH+を反応する 相手から得るものである。
出典:マナペディア
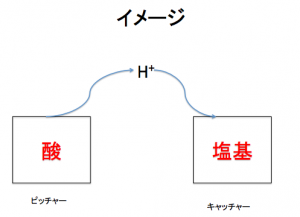
酸は水素イオンのピッチャー!
塩基は水素イオンのキャッチャー!
こう考えて!
アンモニアは、
![]()
この反応式で反応します。
左辺を見てください、
アンモニアは水から水素イオンを投げつけられて、
キャッチしています!
ということは、
ブレンステッドの定義によって
アンモニアは『塩基』となります!
右辺のアンモニウムイオンを見てくれ!
アンモニアの電離は可逆反応だから、
右辺から左辺にも進む!
アンモニウムイオンは水酸化物イオンに
水素イオンを投げつけるから、『酸』と言うことに
なるんだ!
理論化学の問題を解く上で重要な定義は?

重要定義
そういうことではないねん!
実は計算問題を解く上ではほとんど、
『アレニウスの定義』が使われるねん!

入試問題の理論化学の計算問題では、
化学反応式の代わりにモルの関係式を

酸塩基の関係の付け方
で表します。
次の記事やその次の記事で
紹介していきます、中和滴定の問題でも
この関係式を立てていきます。
つまり、
『中和滴定』などの計算問題を解くときは、
ブレンステッドの定義は使わないのです。
水と反応して水酸化物イオン(OH^-)を
投げつけている!
と理解すると問題が解きやすいんだ!
それでは具体的にどのような式を立てるかを
見ていきます!
しかし、その前に『価数』について分かっておかなければならないのでその説明から入ります。
価数とは?

具体的な立式
水素イオンモル=水酸化物イオンモルは
実際にどのように立てられるかご覧ください!
以下
酸のモル濃度をCa
塩基のモル濃度をCbとします!
塩酸と水酸化ナトリウムの中和

このように最後の赤文字の『価数』を
忘れずに掛けましょう!
今回は塩酸は1価の酸なので1を掛けます。

そしてこちらも水酸化ナトリウムの価数1を
掛け忘れないようにしましょう。

また注目してもらいたいのは、
キッチリ計算の各段階で
『どの物質の単位か?』と言うのを
書き記していってください。
こうすることで、
価数を掛けて水素イオンのモルに変えないと!
と思えるわけです!
硫酸と水酸化ナトリウムの中和

硫酸反応式
このように2価の酸である硫酸の場合は、
×2を忘れないようにしてください!
またこの計算式でもキッチリ各段階の
単位を書き記しているのが分かると思います。
これは濃度変換の問題でも学んだと思います。
「モル濃度とパーセント濃度を脳みそを使わず変換する計算法」
大幅にケアレスミスが減りました!
このテクニックは酸塩基に関わらず
使っていってください!
今日はここまでです!
次も酸塩基に関する話題なので、
今回の内容が基礎となります。
キッチリ復習していきましょう!
















お久しぶりです。
今回も質問があるので、コメント致します。
①センター試験の問題では、「炭酸カルシウムに塩酸を注ぐと、二酸化炭素が発生する。」という形で出題されることもありますが、これが何の反応なのかを見極めるのに、反応式を書いたほうが良いでしょうか。
②それと、そもそも反応式を見ただけで 酸化還元反応なのか、酸塩基反応なのか、他の反応なのかが分かりません。
e-が移動している、H+が移動しているというのは同じことのように思えるのですがいかがでしょうか。
宜しくお願いします。
①>問われている内容によりますね。
②>酸塩基が反応していたら酸塩基ですし、酸化剤と還元剤が反応していたら酸化還元ですし、
分解されてたら分解反応です。
どういうのがわからないか
いくつか出していただければ、
判断出来るべきか言えるのですが、、
9つ挙げさせていただきます。
(使っているテキストの引用です。)
A.酸塩基反応の利用
⑴硫化鉄(Ⅱ)に希塩酸、または希硫酸を注ぐ。
⑵炭酸カルシウムに塩酸を注ぐ。
⑶亜硫酸ナトリウムに希硫酸を注ぐ。
⑷塩化アンモニウムに水酸化ナトリウムを加えて熱する。
B.酸化還元反応の利用
⑸水素よりもイオン化傾向の大きな金属と塩酸や希硫酸を反応させる。
⑹銅に熱濃硫酸を加える。
⑺銅に濃硝酸を加える。
⑻銅に希硝酸を加える。
⑼酸化マンガン(Ⅳ)に塩酸を加えて熱する。
以上になります。
お忙しいところお手数をおかけしますが、ぜひ 宜しくお願いいたします。
Aとかは結構塩が多いので、
水と反応させて見たら良いと思います。
その後、反応させれば良いと思います。
Bは酸化還元としておもったほうがいいですね。
反応式を書くときは、半反応式が必要ですので、
濃硝酸、希硝酸、熱濃硫酸の半反応式は
あまりにもゆうめいなので
その瞬間判断は出来ないとダメです。
具体的にどう考えればよいのか良く分かりました!
本当にありがとうございました。
これからも 宜しくお願い致します。
こちらこそよろしくおねがいします。
仮に酸塩基反応で酸化数を考えたとき、酸化数が変化してたらそれは酸化還元反応ともいえますか?
いえます。