こんにちは。
今日は少し普段と趣向を変えて、問題を解説してみようかと思います。
一度質問が来ていた『電気分解の並列回路』です。
特に難しいこともなにも無いのですが、一度触れておくのと置かないのとでは本番での安心感が違うでしょう。
一度トレーニングしておきましょう。
目次
秋田大学の問題

白金板を電極とした電解槽A,B,Cを上図のように接続して、電気分解を行った。回路Iの電解槽Aには食塩水が入れてあり、容易局と陰極の間は陽イオン交換膜で分離してある。回路IIの電解槽Bには硝酸銀水溶液が、電解槽Cには希硫酸が入っている。電流計が5.00Aになるようにして64分20秒通電をしたところ、電解槽Aの陰極液中には(a)が(b)g生成した。
また、電解槽Bでは、陰極の質量が5.40g増加した。発生する気体は、水に溶解したり、副反応を起こしたりせず、理想気体として取り扱えるものとする。ただし、ファラデー定数F=9.65×104C/mol log102=0.30、原子量H=1.0,O~16,Na=23,Cl=35.5,Ag=108とする。(1)は3桁,(2)~(4)は2桁で答えよ。
(1)回路I及び回路IIに流れた電気量はそれぞれ何Cか、計算せよ。
(2)文中のaを化学式で,bを数値で答えよ
(3)電解槽Cの陰極で発生する気体は標準状態で何Lか。
(4)電解後、電解槽Bの溶液のpHはいくらになるか。ただし、溶液の体積は250mLとする。
出典:重要問題集151 秋田大学
この問題のポイント
まず、もちろんですがこの問題は電気分解の知識が無いと解くことは出来ません。電気分解の基本的な知識を身に着けている前提で話をススメます。
まだ、電気分解の基本がわかっていない人は、答えを見る前に基本を学び、その後に自分で解いてから読み進めていってください。
『電気分解の基本』
それでは、この問題のポイントをまとめてみます。
②(1)の電気量の求め方
③NaOHの工業的製法
④電気分解の基本的な扱い方
この4つがポイントです。それでは、実際に解いていきましょうか!
まずやること
どんなことよりもまず最初にやるべきことというのが、Aを見つけたから即座に電子のモルを求めるということです。

これでAを電子のモルに変換するのでした。この問題で言うと、5.00Aを64分20秒流すので、5.00×(64×60+20)/96500で電子のモルを求めます。
つまり、電流液電子のモルは0.2molでした。
各電解槽の情報まとめ
電解槽A
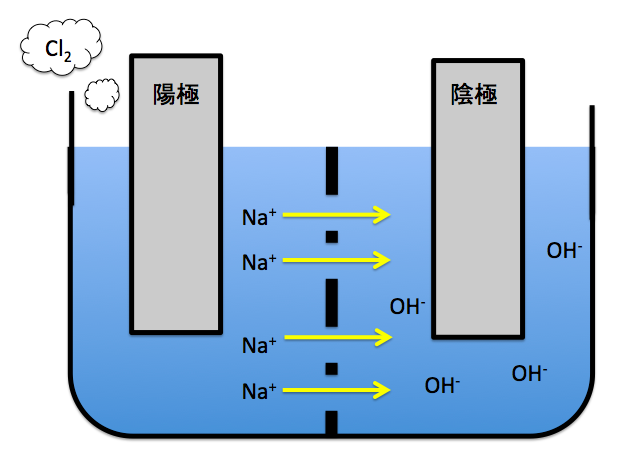
この反応は、NaCl水溶液を電気分解することでNaOHを得る有名な『陽イオン交換膜法』です。詳しくはこちらの記事で解説しています。
この陽イオン交換膜法というのは、別に新しいことを学ぶ必要はなく、電気分解の基本さえできていればイオン交換膜法は知らなくても解けます。

この問題において、負極とつながっているのは右側の極板ですので、右側の極板が陰極です。
この電解槽での半反応式は、
(-)2H2O+2e-→H2+2OH–
(+)2Cl–→Cl2+2e–
のようになります。
ちなみによくこの陰極の反応の『水関連の半反応式』が作れないという質問がよく来ます。別に丸暗記する必要はなく俺も全く覚えていません。
毎回作り出しています。その方法は【暗記不要】水が絡んでくる半反応式の書き方で解説しています。
そしてこの反応が進むと、陰極でOH–が発生していき、陽極のNa+が陰極に移動していきます。こうなると、陰極にNaOHが完成します。
ちなみに、NaOHのmolはOH–のmolと同じですよ。これですこし詰まってしまう人も居るんですが、当然です。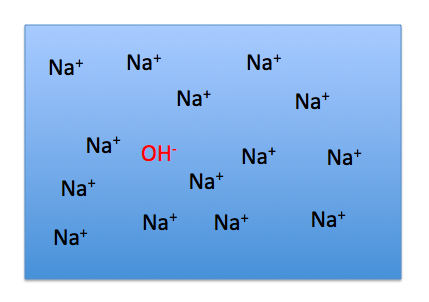
こういう状態だったとして、NaOHは何個できたことになりますか?
1個ですよね。Na+がいくらたくさんあろうとも、NaOHになるのは、OH–が1こしかないのだから1個だけです。
電解槽B

電解槽Bには硝酸銀水溶液が入っています。なので、陰極にはイオン化傾向が小さいAg+が電子を受けとり銀が析出します。
ちなみに、この析出した銀の質量が問題で与えられています。銀のmolがわかる→電子のmolがわかるということです。
だって、Ag++e–→Agという反応が陰極で起こっているからAgのmolがわかればe–のモルも銀のmolと等しいです。
このB槽の半反応式は、
(-)Ag++e–→Ag
(+)2H2O→O2+4H++4e–
のようになります。
電解槽C
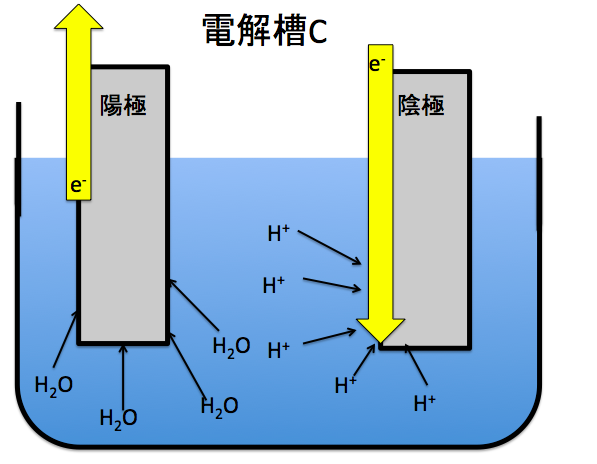
電解槽Cは水の電気分解です。水の電気分解は中学の時からやってきたと思います。陽極に酸素、陰極に水素が発生する反応です。
硫酸が入っているので、酸性条件です。
極板ごとの反応式をまとめると
(-)2H++2e–→H2
(+)2H2O→O2+4e–+4H+
このようになります。
(1)の解法
まず回路(I)と回路(II)の電気量を求めます。今回は、電気量をいきなり求めたほうが早かったですが、俺は常に電子を一瞬で求めるというスタイルを取っています。
なので、電気量の前にすべての回路を通る電子のモルを求めてみました。
並列回路の扱い方
並列回路の扱い方は特に難しいものは無いです。小学生とか中学生から並列回路は電流が別れると習ったと思います。
それと同じです。電流の逆向きに流れるのが電子ですので、全く同じように電子も並列回路の場合別れます。
このようになります。回路IIの0.05molは銀の質量から求めました。回路Iの電子のモルは0.2-0.05で求めました。
回路Iの電気量は、0.15×96500=14475≒1.45×104C
回路IIの電気量は、0.05×96500=4825≒4.83×103C
となります。
(2)の解法
電解槽Aつまり、イオン交換膜法の電気分解について問われています。
イオン交換膜法では陰極で(a)NaOHができます。そして、出来上がる質量ですが、NaOHのmolはOH-のmolと同じですので、NaOHは0.15molあります。
質量ですので、0.15×40(式量)=(b)6.0g
となります。
(3)の解答
ここでは、電解槽Cの水の電気分解が問われています。

(-)2H++2e–→H2
(+)2H2O→O2+4e–+4H+
これですよね!
そして、陰極で聞かれているので、(-)2H++2e–→H2この式が重要でした。回路Iなので、電子は0.15molです。ってことは、水素のmolは0.15×1/2です。
これより0.15×1/2×22.4=0.56L◯
(4)pHを求めよ!
こういう電気分解でpHも問われると、なんだかわけわからなくなる人も居ますが、実際大したことはないです。
pHを求めるときに必要なものって何ですか?
[H+]か[OH–]ですよね。じゃあまず方針として、この2つのどちらかを求めよう!と思います。
mol/Lを求めるんです。そして分母のLは250mL=0.25Lとすでに与えられています。つまり結局この問題で問われていることなんて、
水素イオンが何モルですか?っていう激しくくだらない問題なんです。このように、何が問われているのか?を正確に分解していくと、複合問題ってめっちゃ簡単な場合が多いです。

(-)Ag++e–→Ag
(+)2H2O→O2+4H++4e–
この反応式ですので、電解槽Bの電子のmolは0.05molですよね。電子:水素イオン=4:4=1:1ですので、
0.05×1が水素イオンのモルです。
0.05÷0.25=0.2mol/Lです。
ここからpHを求めます。
pH=-log100.2=(1-log102)=0.70となります。
まとめ
一番大事なことを言うと、ここまででわかっていたと思いますが、『すべて電子のモルから考える』ということです。
理論化学なんて『モル求めて』『モル比で別の物質のモルを求める』だけなんです。この2つ。
理論化学の超根本的なところをまず見直してみてください。
すべての基準は電子のモルです。電子のモルがわかっていないときは、電子のモルを求めることに徹底し、電子のモルがわかった後は、電子のモルからすべてを求めるのです。
だから、設問とか全部無視して、まずは電子のモルを求めることを徹底すべきです。
最後に
問題解説はやっぱり先程の情報に飛んだり、さっき使った情報を元に解いたりします。だから、動画で同じホワイトボード内で収める方が圧倒的に効率よく理解してもらえるなと思いました。
多分、今後は突然問題を解いていくシリーズは動画コンテンツになるでしょう。
それでは!















コメントを残す