どうも、受験化学コーチなかむらです。



理論化学が化学の中で一番苦手な人も多いのではないでしょうか?
理論化学は考える力がある人にとっては「めっちゃ楽だな」って思う一方で、暗記頼みの勉強をしているとピタリと全く成績が伸びないんですよ。
実は、理論化学っていろんな問題を覚えれば覚えるほど解けなくなり、1個の方針で問題を解けばあらゆる問題にも応用できることをご存知でしょうか?
これまで『理論化学だけは解けずこのままでは志望校に合格できない』と悩んでいた受験生を救い続けてきたノウハウを公開します。
「理論化学というものがどういう学問なのか?」 という根本的な部分にさかのぼって学んでいきますので、ぜひ最後までお読みください。
[quads id=5]目次
理論化学とは?〜そもそも論〜

そもそも理論化学とは何か? ということを考えたことがあるでしょうか?
理論化学をWikipediaで調べると
理論的モデルや数式を元に、既知の実験事実を説明したり、未知の物質の性質などを予言したりする演繹的なアプローチを行う化学の方法論である
出典:Wikipedia
と書かれています。Wikipediaだけでなくだいたい同じことが書かれています。
つまり、理論化学で大事なことは

ってことなんですよ。
演繹とは帰納の逆で抽象的な物を具体化するってことです。数学的帰納法はn=1の時、n=k、n=k+1と具体的な事象から抽象化しますよね。
逆にan=2n+1などと与えられた物をn=1の時は?a1=3とn=を具体化することを演繹と言います。

理論を問題ごとに当てはめるのが理論化学なんですよね。
ってことは! 問題集の問題をいくら解きまくって具体的な問題を覚えたとしても意味がないんですよね。

全部問題集を片っ端から覚えようとします。
でも、そもそもそれは理論化学という学問に反する行為なのです。ではでは、

って思いますよね。
もう答えはいっているんですがシンプルです。抽象的な解法や概念を理解して個別具体的問題に下ろす練習をするんです。
理論化学の大学受験入試問題は2パターン

理論化学は2パターンです。理論化学の入試問題は基本的に計算問題になります。
理論化学の計算問題は「与えられた物理量」から「問われた物理量」を求める問題です。
この「与えられた物理量」から「問われた物理量」を求める方法が理論化学では2パターンあります。
それは、
- 化学変化がない場合
- 化学変化がある場合
の2つです。
化学変化がない場合

化学変化がない場合の最大の特徴は与えられた物理量から問われた物理量を直接計算で求めることができるのです。
例えば、希釈する問題って化学変化がは起きていませんよね。この場合は溶液に溶けている溶質の質量か個数に着目すればいいのです。
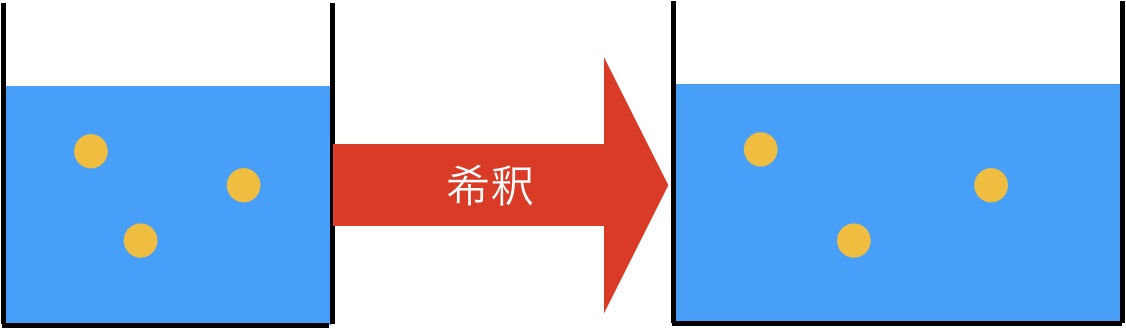
希釈前の溶質の質量=希釈後の溶質の質量
を溶けば希釈後の溶液のモル濃度でもパーセント濃度でもなんでも出せますよね。
このように化学反応が起きない場合は直接求めることができるのです。

これは中学生の時までの理科にあった化学の問題とさほど代わりはありません。
化学変化がある場合

化学変化がある場合は、化学変化がない場合とは違って与えられた物理量から問われた物理量を直接求めることができません。
結論から言いますね。理論化学で化学反応が起こる場合の方針は次の2手順です。
- モルに変換する
- 反応前と反応後のモルの関係式を作る
化学変化が起きているということは、化学反応式で反応前と反応後を関係づけることができます。
2H2+O2→2H2O
この時、反応前と反応後の関係式を作れるのは「モル比」だけなんですよ。
よって、化学変化がある計算問題は一度「モル」に変換する必要があります。

モルに変換します。
このようにモルに変換した上で、モルの関係式を作る方法をご紹介します。

よって、求めたいモルを計算で導出します。
その後モルを問われている物理量に変換するのです。

このように化学変化がある場合は、反応前と反応後の関係式は「モル」で作らなければならないので、直接求められません。
理論化学の勉強法!〜勉強することは3つだけ〜
- 直接求める方法
- モルに変換
- モルの関係式
理論化学は1つ前の見出しで解説した通り、化学変化がないパターンとあるパターンがありまして、基本その2パターンだけです。
そこから導き出せるのが
1.直接求める方法(化学変化がない場合)

直接求められるので、これはその都度考えることになります。
これはそれほど多くありません。なぜなら入試問題の大半は化学反応が起こるからです。
入試問題の大半は化学反応が起こるからです。
2.モル変換(化学変化が起こる場合)

与えられた物理量を「モルに変換」することですが、これを完全に暗記してしまってください。
こういうのをパッパと言えるようにしてください。
もちろん、覚えなくても導出することはできますよ。でもこんなによく使う物をわざわざ毎回導出する意味がありません。
入試問題を説いている時いろんなこと考えてしまうとあっという間に思考力のリソースはなくなってしまいます。
また、モルの導出ができれば逆は簡単です。

3.モル関係式

モルの関係式の作り方は各単元で異なります。
たとえば、酸塩基で中和滴定の問題だったら
水素イオンのモル=水酸化物イオンのモル
で関係式を作りますね。
このように、単元ごとに関係式の作り方が異なります。

と思うかもしれませんが、化学反応式を使ってモル関係式を作ると損することの方が多いです。
なので、その単元ごとにどのようにモル関係式を作るかを学びます。
最後に:理論化学を勉強すればするほどシンプルなことに気づく
- 理論化学は「理論、数式、モデル」を具体化する「演繹」の学問
- 解法を暗記して全ての問題を覚えようとするのは理論化学の原理原則から外れる
- 化学反応がない場合はモルに変換しなくても大丈夫
- 化学変化がんある場合はモルに変換する
- モル変換→モル関係式が理論化学の問題を解く方針
いかがでしょうか?
この視点で理論化学を見るだけで大きく変わると思います。
勉強するとどんどんシンプルになります、
理論化学って、勉強すればするほど
「あれ。全部同じやん」
ってなります。数学と同じで方程式に全部放り込みますよね。
それとおなじです。
— 受験化学コーチなかむら (@kagakucenter) 2019年10月29日
そして、理論化学は勉強すればするほどシンプルになって勉強が楽になっていく学問です。
本記事では抽象的なことを話しました。

ってことは僕の無料メルマガや理論化学の計算講座(有料)で解説をしています。
イメージは無料メルマガはダイジェストで有料講座が完全版というイメージです。無料メルマガだけでもきっかけを掴む人はいますので、ぜひ登録してみてください。
[quads id=5]














ほとんどのところで使えますよ!
今年度もはじまりましたね。先生、今年もよろしくお願いしますm(_ _)m
そうですね!今年も1年間頑張って行きましょう!
よろしくお願いします!
浪人が決まったのですが有機は得意なのですが理論と無機がさっぱりなので参考にさせていただきます
はい!