凝固点降下について、
前回学んでもらったと思います。
で、凝固点降下の問題と
切っても切れない関係、
それが『冷却曲線』です。
この冷却曲線は、
メチャクチャよく入試問題になります。
なので、凝固点降下を
マスターしたと言うために、
冷却曲線をマスターしている
というのは必須です。
というわけで、
冷却曲線に関する知識を
どんどん入れて行ってください!
目次
冷却曲線の見方
まず冷却曲線ってこんなもんです。

横軸は『冷却時間』です。
縦軸は『温度』です。
色々突っ込みどころ満載な図
なんで、見てみましょう!
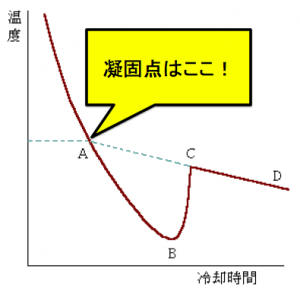
凝固点の場所
まず、凝固点降下やねんから、
どこが凝固点かわからんと、
ダメですよね!
というわけでここが
凝固点です。

ここです。
平坦なところから、
補助線を伸ばして、
ぶつかったところです。
過冷却
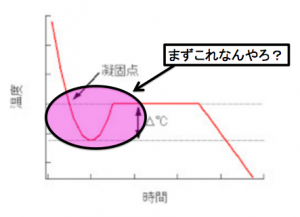
ここでなんでへこんでんねん!
って思いますよね。
このへこんでいる現象を
過冷却と言います。
過冷却が起る理由
なんで過冷却なんて起るんでしょうか?
だって、
普通に凍れや!
って思いますよね(笑)
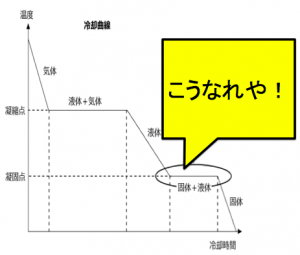
これは、”核“ができていないからです。
核が出来ると、
そこにどんどん溶媒がついていき、
どんどん固まって行きます。
なので、

このようにへこむのは、
核を作っている状態を作っている
段階なんです。
核は凝固点になった瞬間できるわけ
ではなくて、
凝固点を超えても液体のままである
状態を過冷却と言います。
水でも0℃で瞬間的に凍るわけでは
なく、
核を作っている間は、
凍らず温度が下がり続けます!
過冷却の実験
ほうじ茶を-3℃位まで、
凍らしておきます。
でも過冷却状態で、
凍りません。
それを凍りにぶっかけます!
核があればどんどん凍っていくので
その氷の周りにほうじ茶が
どんどん凍っていくという様子がこちら
過冷却状態なので、
どんどん凍っていくというのが、
わかりますね。
純溶液の冷却曲線

純溶液の冷却曲線は
このように、なります。
そして下の画像のようになったとき、
凝固が始まります。

そして、この冷却曲線は、
温度が上昇していますが、
この過冷却の後
温度が上がります。

これは、急激に凝固するので、
凝固熱が一気に発熱されて、
温度が急上昇するからです!
溶液の冷却曲線
溶液の冷却曲線は
純溶液と異なり、このように
なります
この画像のように、
溶液の凝固点は、線を延ばした
この点になります。
補助線をのばし、
その交点の時の温度が凝固点と
なります。
純溶液と溶液の冷却曲線を混ぜると、、
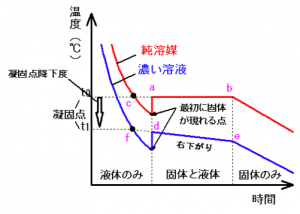
この2つの冷却曲線を混ぜる事で、
凝固点降下度:Δt
を求める事が出来ます。
凝固点降下度Δtfは、

この間を見れば良いだけ!
てことは、この実験をして、
凝固点降下度がわかる、
そして、モル凝固点降下は
溶媒に固有だからわかってる。
質量モル濃度わかるやん!!
質量モル濃度がわかって、
溶液の質量がわかっているとして
くださいよ!
分子量わかるやん!!
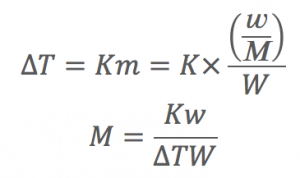
ということでときたま
構造決定の分子量を決定する
タイミングで、
凝固点降下度をグラフから求める
実験が出る事があるので、
きっちりマークしておいて
下さい!
ということで、凝固点降下と
一緒にこの冷却曲線も
きっちり覚えておいてください!
それではありがとうございました!














なるほど!!
いつも、参考にさせていただいております。
凝固点降下の問題で、溶液に関しては液体固体共存状態でも温度が一定にならず、グラフは右下がりになることはわかるのですが、その理由が「凝固点降下度が大きくなっていくため。」と、よくあります。
確かに式で見れば、濃度が大きくなるため、凝固点降下度が大きくなるのはわかるのですが、グラフで見ると、下がってる間の凝固点がどこに当たるのかわからないので、よくわからなくなります。
お願いします。