こんにちは。
今日は、久しぶりに理論化学の内容で、『ダニエル電池』について解説していこうと思います。
なんとちょうど1年前の同じ月にボルタ電池についてまとめているんですよね。
普通ボルタ電池書いたら、ダニエル電池書くやろ!(笑)って思うでしょう。1年越しに続きという感じです。
(まあ、色んな人から、ダニエル電池が見当たりません!みたいなメールが来るもんで重い腰をあげました)
とはいえ、鉛蓄電池のように特殊でもないしそれほど難しくないので、すぐに理解できると思います。ただ、ダニエル電池を読む前にかならずボルタ電池についてと酸化還元の定義については読んでおいてください。
ダニエル電池はボルタ電池の欠点を攻略して実用的になった電池ですので、ボルタ電池の知識は必須です。
目次
ダニエル電池とは?

出典:wikipedia
ダニエル電池は初めて実用的に使えるようになった電池です。
仕組みで言うと、ほとんどボルタ電池と同じなんですよね。ボルタ電池は、正極で亜鉛が投げた電子を受け取るのが、水素イオンだったのですが、ダニエル電池の場合はそれがCu2+が受け取ります。
つまり、起こっている反応で言うと、ただこれだけなんです。

つまり、Zn+Cu2+→Zn2++Cuではこれを詳しく極板ごとに見ていきましょう。
まず負極(=還元剤)の亜鉛板では以下のように亜鉛が電子を放出します。
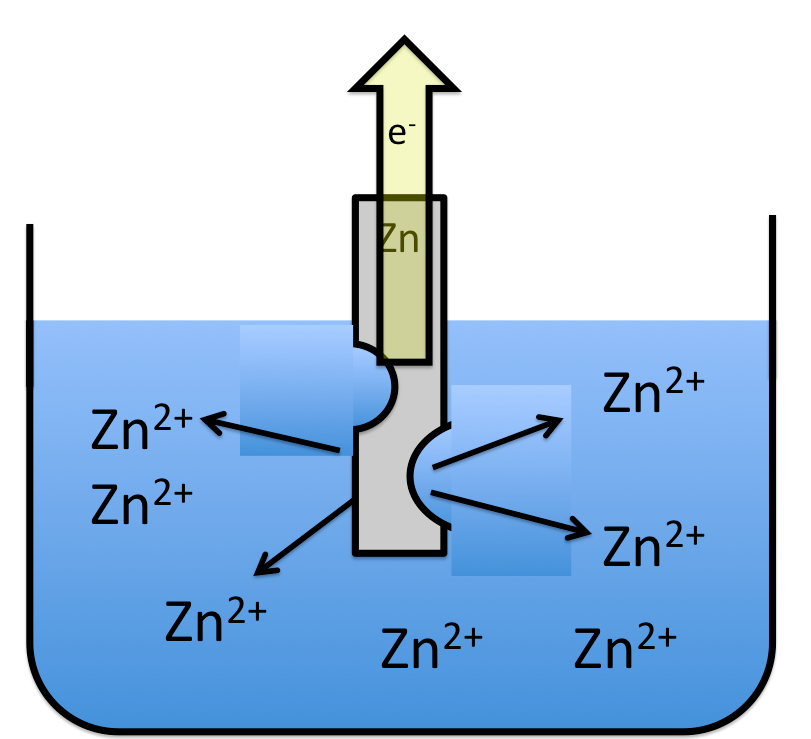
このように、亜鉛板の亜鉛を亜鉛イオンにすることで、電子を放出します。反応式は、
Zn→Zn2++2e–
これによって導線を電子が流れます。
この亜鉛が吐き出した電子をキャッチするのが、銅イオンです。この銅イオンが電子をキャッチして銅が生成されます。

このように溶液中の銅イオンが電子を奪いに極板に群がってきます。反応式は
Cu2++2e–→Cu
となります。
出来上がった銅は、銅板の周りにへばりつきます。

このようになります。この負極と正極を合わせると、ダニエル電池になります。

そして、注目してもらいたいのが、この真中の孔が空いた仕切りです。この仕切のことを『素焼き板』といいます。
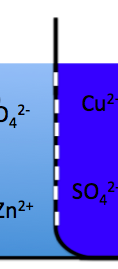
素焼き板は、イオンは通過することができます。なので、負極はどんどんZn2+が増えて、正極はどんどんCu2+が減っていきます。

ちなみに、ここで硫酸亜鉛は薄くて、硫酸銅は濃い。
この後反応して


このように、反応していくと、負極(亜鉛側)はどんどん亜鉛イオンが増えていきます。そして正極は、濃かった硫酸銅の銅イオンだけが反応し、硫酸イオンだけが多い状態になります。
ここで、イオンだけを通す素焼き板の登場です。
亜鉛イオンと硫酸イオンを交換するように、移動します。

という感じでダニエル電池は作用しています!
それでは、きっちり復習しといてくださいね〜〜
、、、
、、、、、

と思ったことでしょう。そう、実はここまでは、事実を述べてきただけです。つまり、ダニエル電池ではこういうことが起きているんだよ〜って言うことを説明しただけです。
そして、ここからが本番です。ここまでを読んでたくさん疑問が湧いたと思います。
「どうして亜鉛の方は薄くて銅の方は溶液が濃いんだ?」
「どうしてイオンが移動する必要があるんだ?」
「どうして素焼き板がそもそも必要なのか?」
などなどがあると思います。ここから解決していきます。しかし、漫然と読むことに意味はありません。
だって、ダニエル電池の原理を覚えても、ダニエル電池がピンポイントで出る確率なんて相当低いです。
それよりもなぜ、ダニエル電池でこのような反応が起こるのか?というのを考えながら読むほうがよっぽど重要です。
なので、必ず今あげた疑問点はこのブログを読みながら考えてから読み進めてくださいね!
なぜ硫酸亜鉛溶液は薄く、硫酸銅溶液は濃いのか?

このように、ダニエル電池は硫酸亜鉛側は溶液が薄くて、硫酸銅側は溶液が濃いんですよね。この理由について考えていきましょう。
硫酸亜鉛水溶液を薄くしておく理由
まず、亜鉛板側の話からしていきましょう。

亜鉛板、つまり負極というのは電子を吐き出す側となりますよね。なので、
Zn→Zn2++2e–
という反応が起こります。Znの金属がZn2+となって溶液中に溶け出すのです。
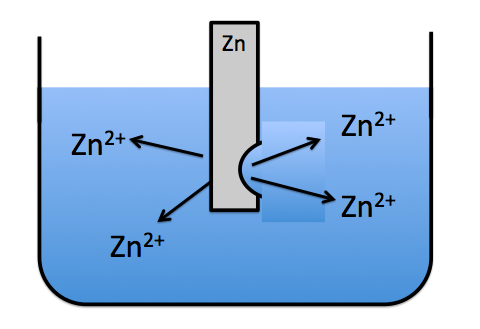
このように亜鉛イオンとして解けまくっていきます。しかし、いくらよく解けるからって限界があります。
塩化ナトリウム(食塩)だって、溶解度という概念がありましたよね。つまり、NaCl→Na++Cl–という反応にも、限界量があります。
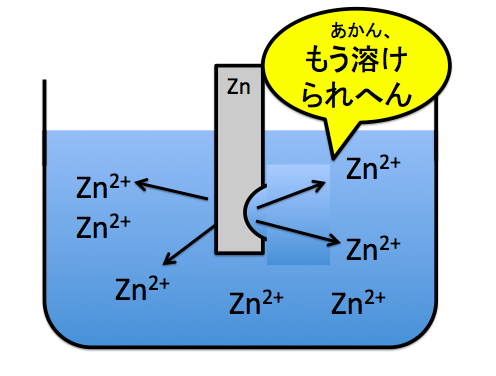
それと一緒で亜鉛もいずれは溶けなくなります。解けなくなると、Zn→Zn2++2e–の反応が起きて、電子が流れなくなります。
もちろん、いずれは限界は来ますが、電池はできるだけ長い間使えたほうがいいですよね?だから、Zn2+が解ける場所はたくさん確保できたほうがいいんです。

これよりも
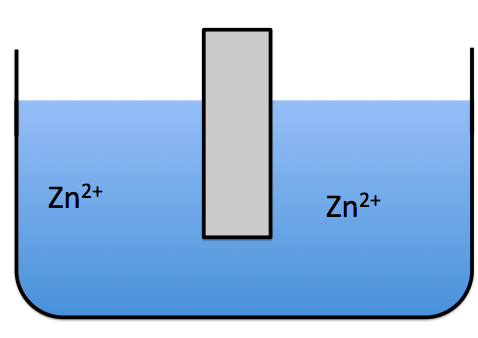
これのほうが亜鉛が溶けやすいと思いませんか?なので、最初硫酸亜鉛は亜鉛イオンを少なくしておくためにうすくしておくんです。
硫酸銅水溶液を濃くしておく理由
では、次に硫酸銅水溶液を濃くしておく理由です。
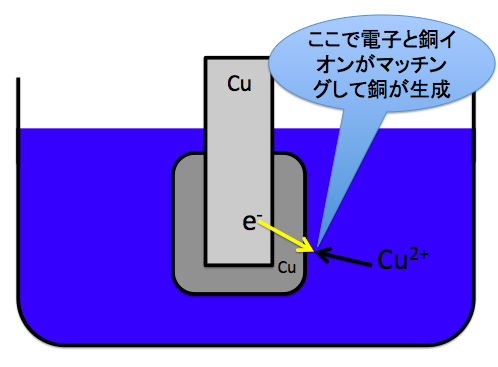
このように溶液中のCu2+と電子e–が反応してCuが生成されます。
Cu2++2e–→Cu
このようになります。そして、銅板の周りに銅がくっついているのがわかると思います。
じゃあ、もしもし、この溶液に銅イオンがめちゃくちゃ少ない、すなわち硫酸銅水溶液が薄かったらどうなるでしょうか?
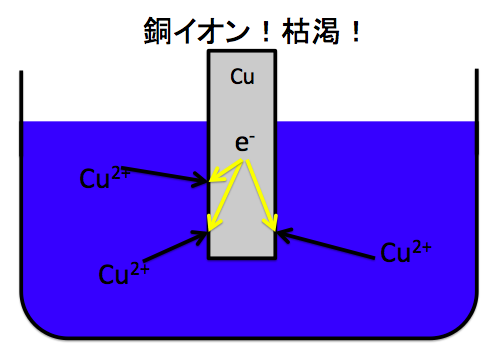
Cu2++2e–→Cuの反応が起きて、すぐにCu2+が枯渇して、亜鉛イオンが投げた電子を受け取るイオンがなくなってしまい電池に電流が流れなくなる。
だから、
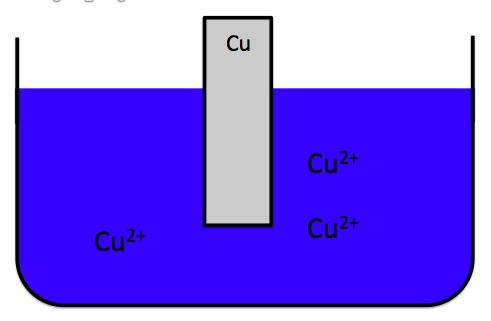
このように銅イオンが少ない状態ではなく、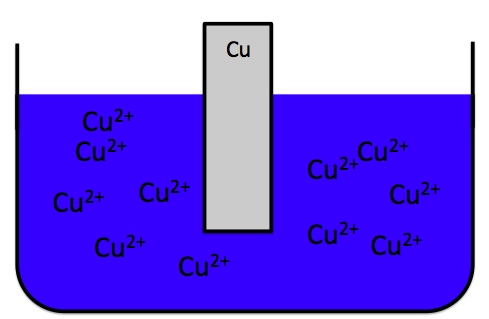
Cu2+がたくさんある、つまり硫酸銅水溶液の濃度が濃いほうが電池の寿命が長くなるのです。
なぜ素焼き板なんてものが必要なのか?
それでは、いちばん重要な素焼き板について勉強していきましょう。
素焼き板というのは、溶液でイオンだけを通す板です。ニュアンスで言うと、素焼き板というのは半透膜みたいなもんです。実際にこの素焼き板をセロハン膜のような半透膜に変えてしまっても大丈夫です。
素焼き板を置いておく理由は2つあります。
2正極、負極の電荷のバランスの調整
この2つ。それでは、この2つの理由をひとつずつ説明していきましょう。
1溶液が混合しないため

溶液が混合したらどういうことが起きると思いますか?
数分でもいいので、この記事を開けながら考えてみてください。
、、、、、
いいですか?
まずダニエル電池ってのは

これです。Znから電子を投げてCu2+が受け取る。その間に出たエネルギーを取り出して電池として使っているのです。つまりは、亜鉛から銅イオンに投げる電子は『導線を通る』必要があるんです。
でも、溶液が混合すると銅イオンが直接亜鉛板と反応することが出来るんです。
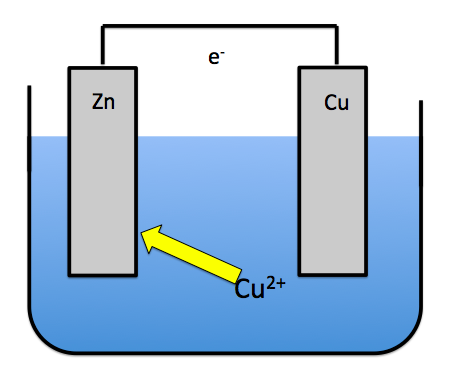
こうなると電子が導線を通ってくれません。
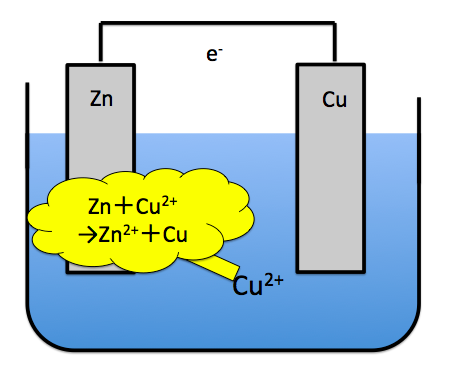
亜鉛板付近だけで反応が完結してしまうと、エネルギーを取り出せませんので電池としての機能を満たすことは出来ません。
2正極,負極の電荷のバランスの調整
ダニエル電池の素焼き板を用いる理由として、電荷のアンバランスを正すというのがあります。とはいえ、これは電池の原理のところですでにまなんでいます。
電池っていうのは、遠距離恋愛でしたよね!そして電子という愛を投げまくった還元剤くんに対して電解質を通して愛を返すのが酸化剤ちゃんでした。
反応が進むと、負極では亜鉛がどんどん電子を投げて亜鉛イオンになり、正極では銅イオンがどんどん電子を受け取ってどうになります。
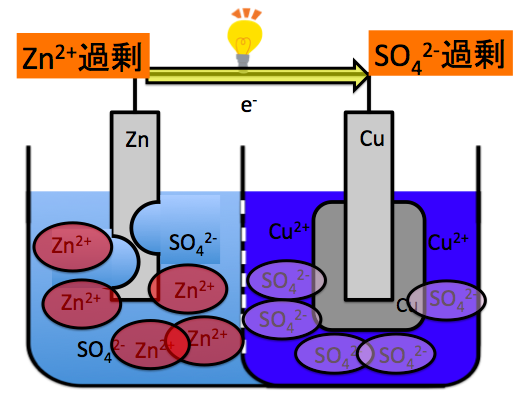
この状態では、亜鉛は電子を投げにくいのです。だって、負極に電子を欲しているZn2+という陽イオンがいて、投げる相手には電子で満たされているSO42-が居るんですよ。
こういう状態だとどんどん起電力が下がります。
そうすると、電流が流れにくくなってしまいます。だから、陽イオンの亜鉛イオンは銅板の方へ、陰イオンの硫酸イオンは亜鉛板の方へお互い移動します。

素焼き板はこのような役目を担っています。
最後に
いかがでしたか?もちろんダニエル電池は重要なんですが、結局は電池の原理で説明したことから何一つ外れていないですよね。
以下に基本事項が重要か?ということがわかったと思います。
基礎を完璧にすれば、ダニエル電池をまるごと覚えるなんてことはする必要がなくなるので、どんなものへも応用可能な基礎を身に着けていきましょう。















ダニエル電池の根本の原理が知れてよかったです!周りと差をつけれた感じです。
それな❗️
負極側が薄ければ薄いほどいいことはわかりますが、薄いにも限度があると思います。蒸留水ではダメなんですよね?
電池の原理的にダメです。
今まで素焼き板の存在をそこまで気にしていなかったので、その役割を知れて良かったです。
素焼き板重要ですねー
ZnイオンとSO4イオンがお互いに移動すると、どうして電流が流れやすくなるのかがよくわかりません。教えてください。
電子を投げ続けると片方の溶液がマイナスに偏る、もう一方がプラスに偏ります。
溶液のプラスとマイナスのバランスを調整するために、イオンが移動します。
いわゆる起電力が下がってしまうのです。
素焼き板の意味ですが、1で溶液が混合しないため、つまりCuイオンが直接Zn板と接触しないためとあるのに、2で電荷のバランス調整のため過剰になったZnイオンがCu板の方へ移動となっていますが矛盾しないのでしょうか?
Znイオンが正極に移動したところで、Cuイオンよりもイオン化傾向が高くて電子は受け取られにくいので、大丈夫だと思います。
なかむらさんの記事を読みながら、大学の再受験のために勉強させてもらってる者です。
横から失礼しますが、特に矛盾しないと思います。
1の、溶液が混合してしまうと不都合が起きるのは、銅イオンが亜鉛板の近くまで来てしまうと、そこで酸化還元反応つまり電子の授受が直接起きてしまい、電子が導線を通ってくれないため電池の意味をなさない、ということが本質かと。
なので、無事イオン化を果たした亜鉛イオンが素焼き板を通って銅板の近くまで移動する分には、すでにイオンになれている亜鉛が、よりイオン化傾向が小さくそのままで居たい銅と反応することは無いので、電池としての機能を阻害しない、よって矛盾はないはずです。
(なかむらさん、不備があったら補足お願いできれば幸いです><)
多分ですが、Zn2+はCu2+よりも電子を受け取りにくいので、あっても反応は進むと思いますよ!
わかりやすくて感動しました。
ありがとうございます!
素焼き板は銅イオンを通さないのですか?
電気的な偏りを埋めるために移動するので陽イオンは移動しません。
あとCu2+は電子を受け取る係なので。
たしかに
とても分かりやすかったです!!!
が、銅イオンを濃くしなくちゃいけない所で
原理はとてもわかり易かったのですが
少し引っかかるところがあります。
銅板は電子を貯めておくことは
出来ないのですか?電子自体が流れてしまえば
電気として成り立つと思ったのですが…
教えてくださる方いれば幸いです。
銅に蓄電能力はないですね。
蓄電するということは難しいのです。
↓鉛蓄電池の原理を見てみてください。
鉛蓄電池の受験テクニック!放電の反応式、モル比に着目!
かなり工夫されて蓄電を実現できているんです。
硫酸亜鉛溶液は濃度が低いほうがいいなら、水ではダメなのですか?
電池の原理的にダメですね。
素焼き板ではなく完全に2つに分けた場合はどうなりますか? コップ2つに亜鉛板と銅板を分けたら電気は流れますか?
最初は流れますが、途中で流れなくなります。
こんにちわ
理由①「水溶液どうしが混ざるのを防ぐ」というのは、eーがすぐCu2+と合わさってしまうのを防ぐということですよね?
ボルタ電池では、発生したeーが水溶液中のH+と合わさらないのはなぜですか?
すみません、ちょっと質問がよくわからないです。
ボルタ電池は発生したe–とH+と合わさりますよ。
ダニエル電池はなぜe–とH+が合わさらないのか?という質問でしたら溶液中にH+が無視できるほど少ないからです。
水が電離しているH+だけですからね。
yellさんの質問の続きなのですが、
ボルタ電池の亜鉛板側で亜鉛が溶けて電子を離した瞬間(銅板に電子が流れていく前)に、亜鉛板側で水素イオンがe-を受け取って水素にならないのはなぜかという質問だと思います。
私もわかりません。
教えて下さい。
電子はH+にキャッチされるより、Cu2+にキャッチされやすいみたいなイメージを持っておけばいいでしょう。
Cuの方がHよりもイオン化傾向が小さいので、早く電子を受け取りたがっていると思ってください。
よりちゃんと説明すると「起電力」が大きいからです。
電位差が大きい方へ電子は移動しますから、電子は銅の方へいきます。
溶液を混ぜた結果、銅イオンが亜鉛イオンの出す電子を奪って原子になってしまうので、素焼き板が必要ということですが、素焼き板はイオンを通せるので、銅が入って電子を奪ってしまうと思います。静電気(+と-)の性質で銅イオンが引き寄せられると思うのですが、何故それでも電池が作動するんですか?数量が誤差ってことですか?
ちゃんと考えてる良い質問だと思います。
そもそも電子が水に溶けてイオンのように変化することなく、導線を伝ってCu板側へ流れていきます。素焼き板で仕切った亜鉛板の方はZn2+でまみれているので、陽イオンのCu2+があえてそちらに流れていくことはありません。
こちらの指摘が正しければ、そもそもボルタ電池は成立しません。
硫酸亜鉛水溶液が硫酸でいけない理由は水素が発生する可能性があるからですか?
そうです!追記しておきます。
こんにちは。
硫酸亜鉛水溶液のなかで、亜鉛がイオンになるのはどうしてですか?
硫酸亜鉛がイオンなので電解質なので、水でとけます。
以下の記事を読んでみてください。
【高校化学】水に溶けるとは一体どういう現象のことを表す?