こんにちは。
今日は溶解平衡について話していこうかと思います。溶解平衡って結構入試問題でも出てきます。しかも平衡というだけあって、化学平衡の問題としてよく出てきます。
今日は溶解平衡が題材になっている問題まで取り上げていこうと思うので、最後まで読んでみてください!
目次
溶解平衡とは?
小学校の時に、水に食塩がどれくらい溶けるかな〜って実験したことはないでしょうか?そして、水が溶けなくなった時点で何グラムだったか?みたいな測定をしたと思います。(まあ今思えば、そんなアバウトな実験あるか!と思うが)
平衡状態って、聞いたことがあるかもしれませんが、反応が止まっているわけではなく、左辺から右辺、右辺から左辺の反応が全く同じ量起こっているから反応が停止しているように見えるんです。
でも実は、反応はし続けているんです。
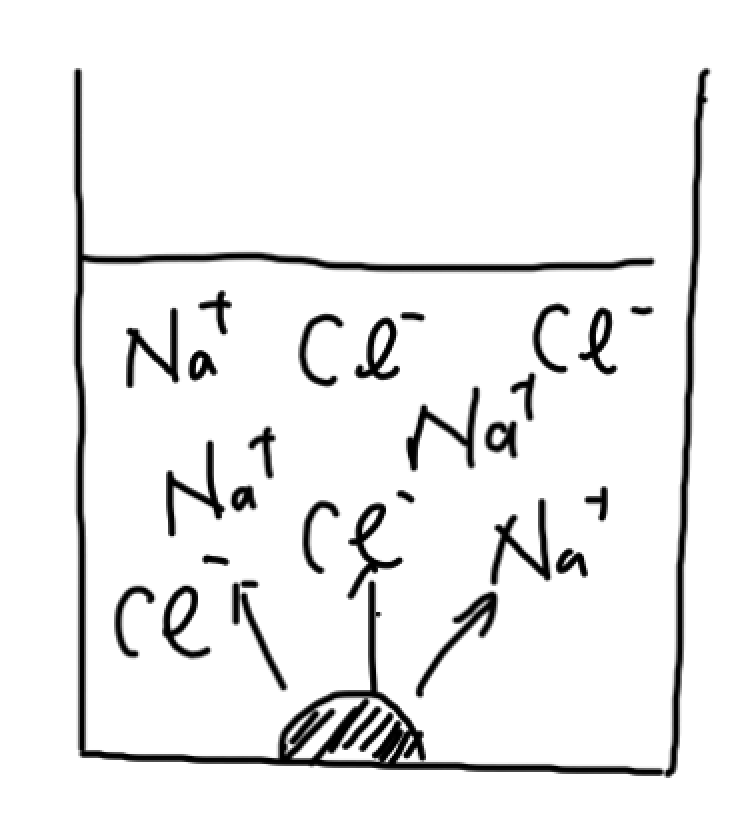
食塩水だって、いずれは溶けなくなっていくんです。食塩水も溶ける限界がきて、溶けなくなり沈殿するわけですよ。
この時は、NaCl⇆Na++Cl–という平衡状態になるんです。

例えば、塩化銀(I)があったとします。
AgCl⇆Ag++Cl–
もう、これ以上溶けられへんって状態を溶解平衡って言います。そして、溶解平衡の時の溶液を飽和溶液と言います。
まあ溶液にも定員があってそれ以上の人は入れませんよ〜。定員を超えたら無理やり入ったら誰か押し出されるよ〜っていうイメージです。

じゃあ、次からは溶解平衡を題材にして、どういうふうな問題が出されるのかを確認していきましょう!
固体の溶解度

これは計算問題でよく入試問題に出ます。例えば、
みたいな問題が出ます。センター試験とかにもよく出てくる問題です。で、多くの人がやりがちなのが、・加熱した場合、・冷却した場合、・結晶水(CuSO4・5H2Oみたいなやつ)の場合、みたいに場合分けして覚えようとするんです。
固体の溶解度の問題はたった1つの方針だけで全ての問題が解けます。
溶解度積という指標

さっき溶解平衡の説明で、「NaCl」と「AgCl」の溶解平衡の話をしました。今回の溶解度積っていうのはAgClでは考慮できるけど、NaClでは考慮することができないんです。
なぜなら、溶解度積は難溶性塩じゃないと考えられないんです。
無機化学で習う沈殿するペア。そもそも塩って「イオン結晶」でしょ。イオン結晶って本来水に溶けやすいよね。でもその例外を無機化学で習ったよね。それが難容性塩であり、沈殿するイオン結晶。
難容性塩の時じゃないと溶解度積を考えることができないんです。多分、この時点でわかっている人は、
ってなってるし、わかってない人は、
は
ってなってるでしょう。
溶解度積は主に3つの使われ方をします。
2つ目は沈殿生成時の初期濃度に対するイオンの残存濃度
3つ目は溶解平衡時の濃度
この3つの問題の出題の仕方に不安がある人はこちらの記事を学んでおくことをお勧めします。
溶解平衡にも応用される共通イオン効果

ルシャトリエの原理を学んだらわかる結構当たり前の効果で、溶解平衡にも関わってきます。溶解度積の問題を解くためにもめちゃくちゃ重要な概念です。
ちなみに、この共通イオン効果は記述問題で書かされることもよくあります。結構共通イオン効果を深く理解できている人は少ないんですよ。
だから、この際にちゃんと理解して記述問題でスラスラかけるように自分で説明できるようにしておいてくださいね!


















しっかり記事を読ませて頂きました。
いつもありがとうございます。
こちらこそです!
これからもどんどん化学を面白く学べる記事を書いていってください!!
いつも楽しみにしてます!!
ありがとうございます!