今日は、電気陰性度について、どれだけこいつを理解するといい事があるかについてお話しします。
電気陰性度と聞いてどう思いますか?
「なんかフッ素が一番大きい奴だろ」
「イオン化エネルギーとか電子親和力と混ざるんだよな〜」
という人が多いと思います。
実は僕もそうでした。
何となくちゃんと区別が出来ないまま、高校生の時は入試を迎えてしまっていました。
この電気陰性度は、それをマスターすると、電気陰性度に関する問題が解けるようになる、というメリットよりは、
有機化学、無機化学、や、酸化物、水酸化物がなぜ酸なのか?塩基なのか?
など、様々な分野の理解が深まり、クソ暗記じゃなくなる事で、勉強時間が大幅に削減できるし、どんどん化学が楽しくなっていきます。
あなたの入試の結果が電気陰性度によって決まると言っても過言ではありません。
それほど様々な分野に関わってくるのでこの記事で確実にマスターして行ってください。
このブログ記事の動画はこちらです。
目次
イオン化エネルギー、電子親和力との違い
これらの違いを本当にちゃんと理解している高校生はほとんど居ないと思います。
この3つがなんかごちゃごちゃになるのは、

グラフが全て似ていることが原因だと思います。
でもこの記事を読み終えればそれはひつぜんだという事が分かります。
必ず最後まで読んでください。
この3つは似ていますが明確に違いがあります。
イオン化エネルギーとは?

イオン化エネルギーは、電子を引き離すために必要なエネルギー。電子親和力は、電子を収めるために放出されるエネルギー。

確かに教科書ではこう書いてあるから、こう教えられますが、なかなか分かりにくいですよね。
これに電気陰性度が加えられたら、そりゃ分からなくなりますわ。

イオン化エネルギーは、“自分”の電子を売るときの値段
電子親和力は、“他人”の電子を買うときに払える値段
これです。
どういう事かというと、イオン化エネルギーは”自分”の電子がどれくらい好きか?という事を表します。
自分の電子がメチャクチャ好きなら他人に渡すときに、『とんでもなく高い値段』をつけますよね。

だって自分の電子が好きだから、
だからイオン化エネルギーが大きい
のは、『自分の電子が好き』で
かなりお金を積まないと渡さないぞ!
と言う意思の現れです。
そして、自分の電子を渡さないという意思がスゴいのは、
閉殻構造でメチャクチャ安定している希ガスですよね!
そして、電子を離したくないと言う気持ちが強いのは、陽子に近い所にある電子、つまりM殻よりL殻、L殻よりK殻となりますよね!
だからイオン化エネルギーを周期表で見ると、右上が大きくなるのです!

イオン化エネルギー 周期表
次に!
電子親和力は他人の電子がどれだけ好きか?と言うことを表します。
他人の電子が好きなら『いくらお金を出してでも買いたい』と思います。

だから、他人の電子をゲットするためにどれだけ払えるか?を表しているのが電子親和力です。
ということは、周期表で見るとイオン化エネルギーとかなり近い図になります。

ただし、今回のグラフは、希ガスが含まれていません。

そりゃそうですよね。希ガスって閉殻構造なんだから、他人の電子なんかいらないです。
既に安定しているんだから。
だから上の図のように、希ガスの電子親和力はひたすら小さいのです。
じゃあ電気陰性度は?
それなら、電気陰性度は何なのか?
これは熱化学でやったと思います、
エネルギー図を書けば全て分かります。
の記事で書きました。
まだエネルギー図を書けないと言う人は、
この記事を読み切った後に読んでください。
物質Aと電子の反応を考えます。
まず、イオン化エネルギーを
エネルギー図に表します。

自分の電子を上げるときに
貰うお金のことですよね。
そして、電子親和力を
エネルギー図に表しますと、
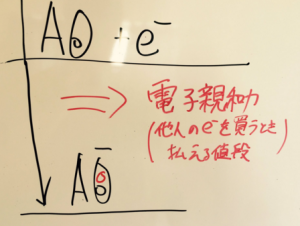
こうなります。
じゃあこの2つを合わせてみましょう!

こうなりました!
そして、これこそが電気陰性度なのです!!
「は?どれだよ?」
はい、これです!

実は、電気陰性度とは、
イオン化エネルギーと電子親和力の和
に比例するのです。
つまり、自分と相手の電子の
『両方を欲しがる想いの強さ』
が電気陰性度だと言えます。
だから、
自分のだけ、他人のだけとかじゃなく、
両方を欲しがる、
つまり、
『共有電子対を引っ張る強さ』
の事を電気陰性度と言うのです。
だからグラフはこんな感じになります。

電気陰性度の確認問題
下表は元素A,B,C,Dの
第1イオン化エネルギー(I)と
第1電子親和力(E)を示した物である。
これら元素間の結合のうちもっともイオン結合性の大きい組み合わせはどれか?
| I | E | |
| A | 1675 | 332 |
| B | 1308 | 72 |
| C | 1251 | 347 |
| D | 494 | 45 |
ちなみに、イオン結合とは、
電気陰性度が大きい物と小さいものの
結合です。
つまり、今回の問題は、
電気陰性度がMAXのものと、
MINのものの組み合わせを
考えれば、イオン結合性が一番大きくなります。
電気陰性度は、
イオン化エネルギーと電子親和力の和に
比例するので、
全部のI+Eを求めればええわけです。
| A | B | C | D |
| 2007 | 1380 | 1598 | 539 |
となる。
だからA-Dの組み合わせが
もっともイオン結合性最大となる。
今日の内容は此所までです。
今日の事はノートなどに、
キッチリ書いておいてください。
これをキッチリマスターしていないと、
有機化学や無機化学のマスターにも
響いてきますので、
電気陰性度は非常に重要です。
それでは最後まで読んでいただきありがとう
ございました。















イオン化エネルギーと電子親和力を、お金で考えてみるのはとても分かりやすかったです!
今まで、なかなか整理がつかなくて混乱していたので助かりました。
もう忘れません!
そうですよね!
なかなか区別が難しい所ですよね!
よかったです。
電気陰性度や、イオン化エネルギー、電子親和力の定義自体は理解していましたが、3つの間に比例関係があるのは初めて知りました。
自分の頭に中で3つが繋がったときにちょっとうれしくて興奮してしまいました(笑
自分でも感動してますw
めちゃめちゃ分かりやすいです!!
今までなんだか混同してて覚えるしかないと思って電子親和力は希ガス抜くとかって覚えてたのが馬鹿みたいですね(笑)
お金に例えるのも理解しやすく、この三つの違いが自信もって言えるようになりました!自分の復習ノートにもまとめました本当にありがとうございます!
おお、ありがとうございます!
センターまでこういうメルマガ続けるので、
是非毎日読んでくださいね!
グラフをみて疑問に思ったのですが、電子親和力がフッ素よりも塩素の方が大きいのはなぜですか?臭素、ヨウ素は小さくなっていってるので分かるのですが…
フッ素の原子半径が小さいので、別の電子を受け取るときに+と近づきすぎるので、少し弱くなるのです。
クーロン力は距離の2乗に反比例しますから。
なんのこと?いっしょじゃん?が そうだったのに変わりました。
大切なことなのはわかります。
うれしい!
ありがとう
結構頑張って理論化学をやってきたんですが、どうも行き詰まってしまいました。数学も好きだし、理論的に考えて、暗記せずにやるのは得意なのですが、どうも理論化学はうまく出来ません。ちなみに僕は独学でここまでなんとかきました。化学の授業で実験などは全く覚えてないので、一からじぶんでなんとかやってきましたが、いろんな参考書や動画を見ながら、いまいちしっくりこないし、先生の言うようにすぐに解法を忘れてしまうのです。化学は得点源にしたいので、お力を貸してください。センターまで、そして二次まで残りの時間を最大限に使って化学を得点源にさせてください。
いつもどれがどれかわからなくなっていたので、お金を使った例えでマスターできました!
ちゃんと整理して覚えたので忘れません!嬉しいです!!
電子親和力は、
希ガスを除いて右上に行くに従って大きいと周期表では書かれているのに、
どうして折れ線グラフだと、ハロゲンのFよりClの方が大きいんですか?
熱化学のところでやった陽イオン 原子 陰イオンのエネルギー準位のとこと似ていて少し頭の中が整理された気がします。間隔を置いて復習し自分のものしていきたいです。
よかったです!
ボルン・ハーバーサイクルのところは特に難しいですからね
質問おねがいします。
電気陰性度のエネルギー図において、どうして、電子を放出する(売る)と安定(エネルギーが大きくなる)のですか?
厳密な理由は高校の範囲外です。バラバラの方が安定して、くっつくと不安定と覚えてもらった方が話は簡単かと思われます。
イオン化エネルギーの方は、自分の電子が好きで高い値段で売るのは安定した希ガスと表記があるけれど
電子親和力の方には、高いお金払ってでも他人の電子を買いたい原子の表記がありません
ハロゲンであるのは、わかるのですが、なぜハロゲンは高いお金をだしてでも買いたいのですか?
希ガスの電子配置で安定するからですか?
あと、お金の説明で電子親和力の右に行くにつれ大きくなる説明とかありますか?
そこらへんが、不十分に感じました
えっと、完璧な理屈を全て説明するためのものではなく、
イオン化エネルギー、電子親和力、電気陰性度の違いを説明したいから作った記事です。
こういうのを揚げ足取りと言います。(揚げ足取れておらず、あなたが単純に趣旨を理解されていないだけですが)
>あと、お金の説明で電子親和力の右に行くにつれ大きくなる説明とかありますか?
そこらへんが、不十分に感じました
これもあなたがこの記事の趣旨を理解されていないようです。
「違い」をわかりやすく解説する記事です。
記事タイトルを見たらわかりますよね?
右に行くにつれて大きくなるのは、
イオン化エネルギーも電子親和力も電気陰性度も同じです。
今回の記事の趣旨は、「全部似ているけど何が違うの?」というところを理解してもらうことです。
だったら似てる部分をあえて説明する必要がないのはわかりますかね?
初めて記事を読みましたが、とても分かりやすかったです。化学が得意になりたいので、これからよろしくお願いします。
よかったです!
ぜひ頑張っていきましょう!
思うのですが、「イオン化エネルギー」とはつまり、「陽イオン化エネルギー」と考えていいのではないでしょうか?
対応して、「陰イオン化エネルギー」というものを考えるとすると、それは「電子親和力」を意味することになりますね。
もっと厳密にいうと、「陽イオン(にさせる)エネルギー」、「陰イオン(になる)エネルギー」でしょうか。
はい、その通りです。思ってOKです。
すみませんが、はっきりと理解はできていないので厳密にいうことはできません。
ただ「負の電子親和力=陽イオン化エネルギー」ではなかったように微かに記憶しているので、「陰イオン化エネルギー=電子親和力」と言い切るのが怖いです。
ちょっと調べてみますね。