こんにちは。
電気分解は酸化還元の応用問題です。
電気分解って聞いただけで、悪寒が走る、何これ覚える事大杉漣wって言う受験生が多いです。
だから今回は、可能な限り覚えやすく、覚える価値のある覚え方をあなたにインストールしていきます。

受験って勉強する事が多いから、丸暗記しているものは、他の勉強をしている間にバンバン消えている。

丸暗記した知識は置き引きされやすいです。
置き引きされると面倒、盗まれたキャッシュカードを止めるかのごとく、思い出して元の状態にするのにメチャクチャ時間がかかる

まだ置き引きされた事に気付いた人はいいが、気付かず、入試に行って、そこで初めて気付く人も居る。

こんな事になっては行けないので、電気分解でもきっちり覚えやすい形で覚えておきましょう!
目次
電気分解とは?
まず電気分解って何か?
これは酸化還元の応用問題です。
酸化還元の定義は

酸化還元反応 定義
この図が表しているものが最重要でした。ちなみに今回の話は酸化還元の知識が入っていないと全くお話にならないのでちゃんと酸化還元の定義は確認しておいてください。
電気分解っていうのは、電気のエネルギーを使って酸化還元反応を起こして溶液を分解したりするものなのでかなり無理矢理感があります。
どういう事かと言うと、
吸熱だから、熱を受け取りエネルギーの高いところに行くのでした。
ですがエネルギーが高いと、不安定と言うのはこちらの記事でお話ししました。

本来下のエネルギーの場所に居たいのに、
電気を流してエネルギーを与えて、
無理やり上に上がってもらう。
それが!電気分解の正体なのです!
つまり、本来起こりたくない反応が起こっているわけです。
『バラバラになるほどエネルギーが高い』っていろんな記事で言っています。(上の記事でも)
うん、
今回の内容の名前思い出して、
『電気分解』だぜ。
もうバラバラにします宣言をすましちゃってる。
そりゃエネルギー使いそうだな!ってセンスのいい高校生は、思っちゃってほしいです。
電気分解攻略へのステップ
電気分解は新しい3つの事を覚えれば、
その後は、普通に酸化還元の問題に
帰着する事が出来る。
この3つのステップを守れば、
基礎が出来ていれば
まず解けない問題は無いはず。
だから絶対にこの記事を、
舐め回すように見てほしい
でも、この記事をテキトウに
チョコバットとかモッサモサ
食いながら見てると、

入試本番で大変な目にあうよ。
そうなりたくなければ、
マジでチョコバットは捨てて、
スマホに集中した方がいい。
音楽も止めよう。
いい?
この電気分解の攻略に必要な③ステップとは、
ステップ1:陰極・陽極の定義を覚える。
ステップ2:電子の流れる向きを確認する。
ステップ3:陰極・陽極における反応しやすさを覚える。
この3つ。
この3つをキッチリ意識して解けば、確実に問題は解けます。
それではこのステップを1個ずつ解説して行きたい。
ステップ1 陰極・陽極の定義を覚える
まず電池を思い出してほしい、電池の負極から電子が出される。つまり負極は還元剤、正極は酸化剤って言う風にお話しした。
そして電気分解の極板もこの電池と大きく関わっている。というか電気分解の電源って電池のことです。
そして、電気分解の陽極、負極の定義というのは、正極とつながっているものが陽極、負極とつながっているものが陰極です。

実はこれ結構ややこしいんですよ。正極と陽極って混同しやすいんですが、正極は酸化剤(電子受け手)で陽極は還元剤(電子投げ手)なんですよ。
だから、問題で陽極、陰極を決定するときは必ず図を書いて、正極とつながっているのが陽極だな〜、負極とつながっているのが陰極だな〜確認するのです。

負極とつながっているのが陰極で

正極とつながっているのが陽極だと毎回確認しましょう。
ステップ2 電子の流れる方向を記す
電子の流れる方向を矢印で書き記すのが非常に重要です。これを書くことで俺は、『陽極がどんな反応が起こり、陰極がどんな反応が起こるか?』とか詳しいことをほとんど覚えていません。
陽極は還元剤
陰極は酸化剤
陽極は還元剤
陰極は酸化剤
と唱えまくって覚えようとしている人も時々いますが、そんなことをするのは無駄です。毎回見たらわかリマス。

酸化還元反応 定義
この定義に当てはめたら簡単です。
どうせちょっとむずい国立大やったら
通用せえへんから。
この酸化剤還元剤の定義をこの電気分解の図に当てはめてみると、

このようになります。定義覚えて、どちらからどちらへ電子を投げられるのかの矢印を書けば、簡単に何が酸化剤で何が還元剤かがすぐにわかります
すなわち、極板での反応が一瞬で判断できるというわけです。電気分解を苦手とする人は必要以上に覚えようとしてしまっているからです。
e–の出所になる陽極では、電極もしくは溶液中の物質がe–を吸熱的に出す反応が起きる。
電池の負極ではe–を放出する酸化反応が起こるけど、
陰極は溶液中のを得る還元反応が起こる。
電池の正極ではe–を得る還元反応が起こるが、陽極はe–を放電する酸化反応が起こる。
同じ反応をするなら別に陽極と正極みたいに名前を同じにすればいいけど、実際は反応が逆になる。だから、違う名前にして同じ反応は起こりませんよって知らせてくれてる。
必ず、陽極自体が放電している反応を忘れないでほしい。だからこの図は陽極から電子が流れている事が分かるだろう。この図を書いた時点で確実に陽極の材質に目がいく。
だって陽極から電子の矢印が出てるんだから。
また陰極を見ると、電子の矢印がちゃんと水溶液まで届いているのが分かるはず。これは、極板は別に反応しなくていいんだよってことを表している。

極板が反応するのではなく、水溶液中のイオンが反応すると覚える事が出来る。
まとめるとこの図をちゃんと書ける事で、陽極は、金属の時はその極板が反応する。陰極は極板ではなく水溶液中の物が反応する。と覚えられる。
実際陽極ももうちょっとおぼえることがあるけど、大事なのは極板によって反応が変わると言う事。
この図を書ければ極板に着目するという観点は得られるはず。
だから陽極から電子が飛び出してる矢印図がメチャクチャ大事。ていうか俺が書いた方がいいって事ちゃんと実践しよう。これ説明のために図書いてるわけじゃないから。
問題を解くときに絶対に書いてほしいから言ってるわけ。
ステップ3 陰極・陽極に置ける反応の序列、反応式を覚える
陰極と陽極では反応が違うのでそれぞれで別の序列が存在している。
陰極に置ける反応の序列、反応式
先の画像を見てみよう。

これを見たら陰極は電子を吸熱的に得る反応が起きてる。
つまり、みんな電子なんてあわよくば受け取りたくない。でもエネルギーやるから受け取ってくれと言うのが電気分解の陰極の反応。
そりゃ電子はみんな基本的には受け取りたくないけど、その中でも
『まあ、最悪俺が受け取ってもいいかな』
っていうやつがいる。
金に目がくらんだやつって感じ。
「電子が嫌い」って言う信念が
弱い奴。
それがよくわかるのが、『イオン化傾向』。
これが電気分解用のイオン化傾向の表。
そしてこの表で見てほしいのは、キッチリブロックに別れていると言う事。
このブロックごとに反応の仕方が変わる。
| イオン化傾向 | K(貸そう)Ca(か)Na(な)Mg(ま) Al(あ)
|
| 陰極の反応 |
イオン化傾向がでかいということは、 このあたりの金属が電子を受け取って
|
| Zn(あ) Fe(て)Ni(に)Sn(すん)Pb(な) | H(ひ) |
| 電圧・濃度・電極の 種類によって、電子を 得ることもあるが、受験では 殆ど電子を受け取らない |
| Cu(ど)Hg(す)Ag(ぎる) |
| 水溶液で
Ag>Cuの順番でe–を受け取ります。 |
| Pt(借)Au(金) |
| イオン化傾向小さすぎます。つまり、こいつらは かなり電子が好きで、もはや非金属レベルです。基本金イオンとか白金イオンはありません。 こいつらは王水にしか溶けないので、 陽イオンをお目にかかれることはほとんど無いでしょう。つまり、そもそも溶液にいないので、 電子をもらうとかそういう土俵に立っていないぜ! |
イオン化傾向ってイオンになりやすさ、
つまり電子が嫌いなほど左に並べられる。
左に居る奴ほど、意思がつよくてどんな事をしても電子は嫌い。嫌いな物は嫌い。
これを逆手に取ればいい。
つまり、イオン化傾向の右側に居る奴らは
(このイオン化傾向の表は、長くなりすぎるから縦のブロックに別れているため一番下の事)
いやいややけども割とエネルギーさえ上げれば電子を
受け取ってくれると考えられる。
すき家のバイトの大学生みたいな感じ。嫌なのに、金がいいからやるみたいな。やりたくない事への信念が弱い。金で揺らいじゃう。今回はエネルギーだけど。
PtとかAuが陰極に
なりやすいんですね。
合ってる。
でも、こいつらは逆に
イオン化しないから
水溶液にならない。
金属のくせに電気陰性度が
かなり大きいから水に溶けて
陽イオンになるなんてことは無いんだ!
そう、Pt、Auはもうすでに電子持っちゃってる。金貰っても電子受け取れない。
だから、その1つ手前のブロックが陰極で反応する。
陽イオンが水溶液中にいない以上、水溶液中でe–を得る反応はあり得ない!
この論理わかるよね
もう一度図を見てみよう。
しつこいけどマジでこの図が大事。

この図をみたら陰極は
矢印が極板で止まらずに、
水中までいってる。
だから、これは水中のイオンが反応する事を表している。それやのに、水に溶けられへん物質が反応するわけないよね。こういう論理。
イオン化傾向Mn~Pbの陽イオンは水溶液の温度とか電圧によって変わります。でもいろいろややこしいからこのあたりの内容は殆ど出ません。
そして
| イオン化傾向 | K(カ)Ca(か)Na(な)Mg(ま) Al(あ)
|
| 陰極の反応 | このあたりの陽イオンは、 イオン化傾向はめちゃくちゃでかい ので、普通に電解しても、 絶対に析出しない。当然電子を受け取らない。 だから融解塩電解をするしか ない! |
| Zn(あ) Fe(て)Ni(に)Sn(すん)Pb(な) | H(ひ) |
| 電圧・濃度・電極の種類によって、 起こることもあるけど、 受験化学ではそれほど気にする 必要がない。(この辺は問題に 出ない) |
| Cu(ど)Hg(す)Ag(ぎる) |
| 水溶液で Ag>Cu>HのMn+順にe–を得る |
| Pt(借)Au(金) |
| 水中で陽イオンが存在しない。 王水じゃないと白金と金を 溶かすことが出来ない。 |
イオン化傾向K~Alつまり、一番上のブロック
(これは横幅的に収まらないので、縦にイオン化傾向を分けている)
この陽イオンは水溶液中の
水和陽イオンの状態が大好きです。
これは電気陰性度をきっちり学んでいる人は、
よくわかっていると思います。
金属は電子が好きじゃないんです!
ちなみに、イオン化傾向と電気陰性度の対応は
きっちりわかっておいたほうがいいです。
イオン化傾向が大きい=電子を拒絶し、電子を投げたい奴ら
=電気陰性度が小さい!
わけですよ。
とはいえ、受験化学において普通に電気分解して
水素より手前が析出することはまず無い
とおもって大丈夫です。
無機の工業的製法関連ではいくらかそのような
ことがありますが、それは例外として
覚えましょう!
先程のイオン化傾向の表の
KCaNaMgAl
貸そうかなまあ
あたりは、電気分解の逆反応だろうと絶対に
電子を受け取らないのです。
だから、代わりに水の電離で生じたH+がe–を受け取ります。
例えば、水酸化ナトリウム溶液で電気分解して
陽極でNaが析出されることは絶対無いわけだ!
だからこれを電気分解の陰極の反応の
指標にすると言う全く新しい使い方が出来る!
イオン化傾向Li~Alは全てその語尾が〜ium。iumと名前がつくくMn+は水溶液でMn+はe–を得ずと覚えておこう。
水溶液の電気分解で陰極で陽イオンがe–を得る反応をまとめて覚えておこう!
陰極の反応の順番まとめ
なので、ここまで説明したので、
陰極で電子を受け取る順番は
もうわかったと思います。
イオン化傾向が小さい金属で、
金や白金のような絶対に溶解しないような
者たちは除くのです。
陽極に置ける反応の序列、反応式
陽極というのは、電子を投げる側ですよね。
本来電子を投げやすいのは、
イオン化傾向が大きい金属です。
途中ハロゲンが電子を投げるという
摩訶不思議な現象が起こりますが、
(ハロゲンって陰イオンが安定だから、
なるべく電子を受け取りたい)
それは、電気分解は無理やり反応を起こす
吸熱反応という前提で御覧ください。
まず陽極が電子を投げる物質には、
順番があります。
一番投げやすいのが、陽極の極板の金属です。
まず、そもそも金属が電子を投げやすい物質ですよね。なので、当然ですが、一番電子を投げやすいです。
粗動の電解精錬なんかで銅の単体を取り出すときに、銅や亜鉛が電子を投げます。
しかし、たまに例外として極板になる物質でも電子を投げないものがあります。それが、白金(Pt)、金(Au)+黒鉛です。
白金や金は王水にしか溶けないので、電子を放出して陽イオンになることはありません。黒鉛も極板に使われることがありますが、基本的に電子を放出することはありません。
ただ、黒鉛の場合は、アルミニウムの単体を取り出す、アルミナの融解塩電解なんかでは高音すぎて燃えながら電子を放出することがあります。
(アルミナ=アルミニウムの酸化物)
アルミナの融解塩電解は例外として覚えましょう。
極板が、Pt,Au,C以外なら極板が電子を投げます。
もし、Pt,Au,Cならば次は、溶液中の
『ハロゲンの陰イオン』が電子を投げます。
例えば、塩化ナトリウム水溶液なんかは、
2Cl–→Cl2+2e–
のような反応が起こることで、電子を放出します。
もし、溶液中にハロゲンの陰イオンがない場合は、次に『水』または『水酸化物イオン』が電子を放出します。
まず、基本的に2OH–→O2+2H++4e–
の反応が起こります。もし酸性や中性だった場合これほど水酸化物イオンがありませんので、ここに両辺にOH–を水に変える分だけH+を加えます。
今回の場合は、両辺に2H+を加えますので、
2H2O→O2+4H++4e–
という半反応式になります。
この水関連の半反応式って電気分解で一番詰まりやすいところなんですよね。でも一切覚えることなんてほとんどありません。
↓こういう質問が来ました↓
硝酸カリウム水溶液の時
陰極 2H2O+2e–→H2+2OH–
陽極 2H2O→O2+4H+ +4e–
になると思うんですけど、
①硝酸カリウム水溶液を中性として考えたとき、陽極はなぜこうなるのですか?
②酸性と考えたとすると
陰極が 2H++ 2e–→H2 のままにどうしてならないのでしょうか…
そもそも硝酸カリウム水溶液は何性として考えれば良いでしょうか、調べても中性と酸性、どちらの意見も出てきて分かりません。
この質問は、そもそも本質ではありません。KNO3水溶液の時点で、電気分解の半反応式は全て決定するのです。なぜなら、水の電気分解において、陰極においては、H+があるかどうか? それだけが重要だからです。
高校化学はこの説明を、「酸性条件なら2H++ 2e–→H2 」と表わしますが、本質じゃないです。なぜならKNO3が例え酸性だったとしても、水溶液中に十分な量のH+が存在しないからです。詳しく知りたい人は、水の半反応式についてまとめてますのでご覧ください1
ちなみに、高校化学において、硝酸カリウムは中性です。
陽極の反応まとめ
ここまでの話をまとめると、
陽極は電子を投げる側である。一番電子を投げやすいのが極板自体の金属であり、その次にハロゲン、最悪水という流れです。
極板の金属(白金や金以外)>ハロゲンの陰イオン>水or塩基性のときのOH–
の順番に放電する。
電気分解の注意点
e–の流れる矢印の書き方に注意!
さきほどから何回も言ってるけど、電気分解の解法ステップ2のe–の流れを矢印で書く書くと言うテクニックだけど、

陽極から電子が出ている事に注意してほしい。
電子からというところ!
つまり基本的に陽極の極板自体が反応すると言う事。
基本的に陽極が反応をするということをメチャクチャ大事やから!
そしてこのことを間違わないようにするためにこの受験テクニックを使っている。
つまり、

この矢印は陽極の上から矢印を書いている。
つまり、陽極の金属の材質を気にすると言う習慣がつく。
だからこの図を書けと言っている。
電気分解で一番たいへんなのは水の半反応式をどう扱うかである!
電気分解で一番むずかしいのは、
水の電気分解が絡んでくるときに、
水関連の半反応式を作ることが一番の難関だと
個人的には思っています。
例えば、酸性条件ならば、陰極では
2H++2e–→H2
という反応が起こりますが、中性塩基性だと、
2H2O+2e–→H2+2OH–
という反応になります。
これだけでも結構混乱しますよね。
なので、こんなものは暗記してはいけません。
暗記せずにちゃんと自分で一からその場で
作り上げる力をつける必要があります。
直列回路と並列回路のe–の違い
直列回路と並列回路って小学生のときに習ったと思います。
直列回路は枝分かれなしの電気回路のことで、並列回路は途中で枝分かれする電気回路です。
小学校や中学校のときの勉強では電気回路で電流でこれをやっていましたが、今回の電気分解では、電子の流れでこれを行います。
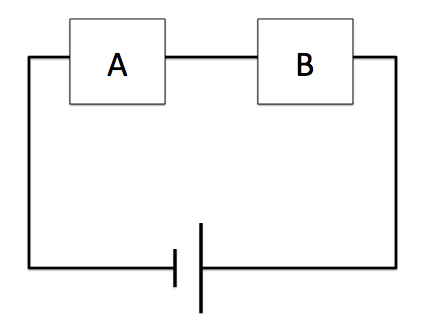
このような直列回路はAにもBにも同じ電流が流れます。つまり、電子の量もAとBは同じ量流れます。
しかし、次のような並列回路は、
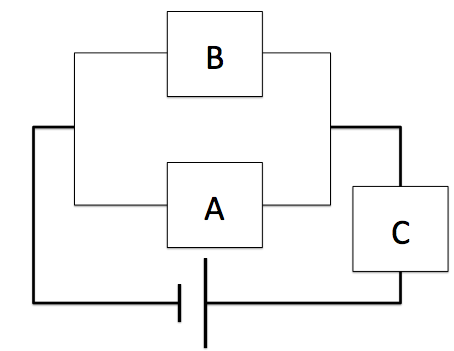
A、Bを流れる電子の量は、Cを流れる電子量と同じになります。A,B,Cそれぞれで電気分解が行われるような問題も出題されます。
例えば、重要問題集2017年版の151番の秋田大学の問題なんかは、まさにこのパターンです。特に難しいわけではありませんが、一度解いておいて慣れておく必要はありそうです。
電気分解の応用〜融解塩電解〜
融解塩電解というのは、非常に荒業でありまする。
その名の通り、塩(中和反応で出来上がる生成物の
水じゃない方)を融解して電気分解すること。
ここで取り出す物質というのは、
ナトリウムやアルミニウムのような
イオン化傾向が大きくて、普通の電気分解では
取り出せないような奴らです。
有名なのはナトリウムやアルミニウムを
融解塩電解で取り出すという反応です。
無機化学の分野で理論化学と絡めるときによく出題されます。
の記事を確実に見ておいてください。
無機の工業的製法は、融解塩電解だけでなく粗銅の電解精錬や、水酸化ナトリウムのイオン交換膜法など、電気分解が絡んでくる方法など、さまざまな物があります。
無機の工業的製法についてきっちりまとめておきたい人はこちら。
『無機の工業的製法まとめ!暗記激減でめっちゃ勉強楽になる!』
最後に
非常に長い記事になってしまいました。ただ、電気分解自体はそれほどむずい問題というわけではありません。
実際電気分解を何問も解いて学んでいくと、結局水の半反応式がちゃんと書けたら、あとはそれほど難しいことは無いな!
って気づけるはずです!
むしろ電池を頑張ったほうがいいです!電池と電気分解は融合問題にされることもしばしばあるので、必ず電池を復習していきましょうね!



















負極で放出した電子は正極にも陰極にも与えられることになりますか?
いえ、電子の流れの矢印の話をご覧下さい
電気分解、電池の仕組み、なんとなく解っていると思っていたけれど、時々陰極、負極があれー?なんで?って解からなくなることがありました。陰極、負極が同じでないといけない、と思っていたんです。同じでなくて良かったんだ。とてもスッキリしました。ありがとうございました。
直列回路と並列回路の電気分解って極板4つの物が問題多いと思うのですが、直列回路と並列回路を解くときの電解層を含んだ回路図の書き方が分かりません。
電池においては負極から正極に電子が流れるのに、電気分解になると正極から負極に電子が流れるのは何故ですか?
書いてあります
硝酸カリウム水溶液の時
陰極 2H2O+2e-→H2+2OH-
陽極 2H2O→O2+4H+ +4e-
になると思うんですけど、
①硝酸カリウム水溶液を中性として考えたとき、陽極はなぜこうなるのですか?
②酸性と考えたとすると
陰極が 2H+ 2e→H2 のままにどうしてならないのでしょうか…
そもそも硝酸カリウム水溶液は何性として考えれば良いでしょうか、調べても中性と酸性、どちらの意見も出てきて分かりません。
よろしくお願いします。
水素イオンがないのに、その反応は起こらないですよね。それだけです。
電子を受け取るから正極と陽極は酸化剤、電子を投げてるから負極と陰極は還元剤という説明がありました。
例えば陽極は確かに正極に電子を投げていますが、私は始め読んだ時陰極から電子を受け取ると考えてしまいました。
この考え方ではどうしていけないのか教えてください。
考え方とかそういう問題ではなく、これは定義なので人間の思考が入り込む隙間はありません。
例えば、1+1=2を
「いや、私は1+1=3だと考えました。なんでこの考え方はダメなのですか?」
と言われてもどうしようもないんです。
一部間違いがあります。
ステップ1の部分で『正極は酸化剤(電子受け手)で陽極は還元剤(電子投げ手)なんですよ。』
間違ってないです。