どうも受験化学コーチなかむらです。

高校の先生はなんだかんだエネルギー図を使うくせに、全然エネルギー図の書き方にまで触れてくれませんでしたよね。
だから、こう感じていませんか?

って。でも、これはめっちゃ勿体ない!! いや、勿体無いどころか危険です。
熱化学の9割の問題はエネルギー図で処理します。
連立方程式の解き方は式が増えれば増えるほど、ミスも増えるし、間違えやすいし、何より遅いです。
なので、今回の記事でエネルギー図をしっかりマスターしてください。
やり方はワンパターンですし、エネルギー図を使いこなせるようになるとぶっちゃけ熱化学の問題に難問は存在しなくなります。この記事でエネルギー図をあなたの受験化学の最強の武器にします。
[quads id=5]目次
【語呂あり】エネルギー図の順番は決まっている。

エネルギー図の書き方をいきなり学ぶ前に、そもそもエネルギー図は上から書くべき順番があることを理解しておいてください。
エネルギー図には、実は上から順番が決まっているのです。何気なく使っているかもしれませんが、このエネルギー図はエネルギーが大きい順に上から並んでいるのです。
そして、さらに物質の世界でのルールで、「バラバラなものの方がエネルギーが高い」という原理原則があるのです。
実際にエネルギー図を見てみると、

ね、上に行けば行くほどバラバラですよね。
この順番です。この順番を完璧に覚えてください!

と思われるかもしれませんので、最強のゴロを紹介します。化学受験テクニック塾、受験化学コーチオリジナルです。
それは、これ。
『いい音(イオン)源(原子)単(単体)価(化合物)完全(完全燃焼)に安いわ(水和)』
この語呂で是非覚えていきましょう。これを覚えていけば、エネルギー図の順番で困る事は減ります!上から順番にこれを使ってください!
これを目安にエネルギー図の順番を覚えてください(時には順番が前後することはあります)
この語呂を使うために、イオンとまとめていますが、陽イオンと陰イオンでは場所が違います。本来は

このように、陽イオン>原子>陰イオンの順番になります。なぜなら、陽イオンは原子が陽イオンと電子にバラバラになっています。一方陰イオンは原子と電子にくっついています。
また語呂で無理やり覚えるだけでは、使えても納得は出来ないですよね。エネルギー図は最終的には、キッチリ理解して使えるようにしてほしいのです。
理解の手助けとしては、エネルギー図の上に行くほど、状態がぐちゃぐちゃになっているのが分かります。
例えば、陽イオンは原子よりも電子と陽子がバラバラになっていたりしますし、原子は単体よりもバラバラです。

(※なので、陽イオンは原子より上ですが、陰イオンは原子より下です。なぜなら原子と電子がくっついた物が陰イオンだからです。)
だから、固体よりも液体、液体よりも気体の方がエネルギーは高くなります。
あと、持っていて欲しい理系としての感覚としてエネルギーが高いほど『不安定』
そしてエネルギーが低いほど『安定』ということを覚えておいてください。
つまり、バラバラなほど不安定で、くっついている方が安定ということになりますね!
○○熱と○○エネルギーの違い
これを読んでいるあなたも、思ったことはあるのではないですか?
「中和熱」とかの『○○熱』と
「イオン化エネルギー」とかの『○○エネルギー』って
熱化学方程式で出てくるけど
なにがちゃうねん、、、
そうですよね〜
なんでこのような区別がなされているのか、イオン化熱ではなんでダメなのか?中和エネルギーではなんでダメなのか?っていうことを疑問に思いますよね。
昔の人も無意味に名前の違いをつけたりしません。この命名の違いには意味があります。この違いをきっちり理解する事で、多くの人がつまづいてしまう矢印の向きや熱量の符号がめっちゃ簡単に理解できます!
この○○熱と○○エネルギーを区別できた瞬間あなたは、熱化学方程式の符号やエネルギー図の矢印の向き全てマスターできるのです!
なので、次の章から1つずつこの熱とエネルギーの違いについて話していきたいと思います!
熱
これは『バラバラ状態から塊状態にする熱量』のことです。
例えば、単体から化合物を生成するのは『生成熱』です。

エネルギー図で言うと矢印は『下向き矢印』となります。
単体または、化合物を完全燃焼すると完全燃焼物になります。このときは『燃焼熱』になります。エネルギー図で言うと矢印は『下向き矢印』となります。

つまり、○○熱の場合は、エネルギー図では、『下向き矢印』を書けばいいのです。
エネルギー
これは『バラバラにするためのエネルギー』です。
例えば、単体をイオンにするときに必要なのは、『イオン化エネルギー』です。

つまりこのエネルギー図で言うと、単体からイオンなので、『上向き矢印』なのです。
他にも化合物を単体に分解するのは、
『結合エネルギー』ですので、
これまた『上向き矢印』です。
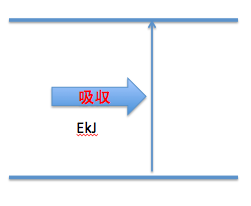
つまり、○○エネルギーの場合は、
エネルギー図では、
『上向き矢印』を書けばいいのです。
まとめ
これからわかるように○○熱はバラバラのものが固まる方向にエネルギー図の矢印を書き、それは『下向き』です!
○○エネルギーは現状からバラバラになる方向へエネルギー図の矢印を書き、それは『上向き』です!
例外
ただし、なんでも法則には、例外がつきものです。例外は、『状態変化に関わる○○熱』です。状態変化に関わる○○熱例えば、蒸発熱などは、『液体が気体になる』など、
バラバラの方向に反応が進んでいます。
なので、
状態変化に関する昇華熱や融解熱などのバラバラになる方向の熱量は○○エネルギーとして扱う。
と覚えておいてください。
じゃあ次は熱化学方程式だ!
正直熱化学方程式を立てなくても問題は解けなくはないが、『熱化学方程式を書け』って問題もよく出るから、これはきっちりマスターしておこう!
よくミスるのが、熱量の符号ねこれも○○熱、○○エネルギーで覚えれば楽勝です。
この見極め方は
下向き矢印(○○熱)なら右辺
上向き矢印(○○エネルギー)なら左辺
と覚えてください。
これがどういうことかというと、○○熱のときは、右辺にQkJと書けばよくて、○○エネルギーのときは左辺にQkJと書けばいいだけです。
○○熱のときはA+B = C+D+Q kJ
○ ○エネルギーのときは
A+B+QkJ=C+D
ということです。
『驚くほど簡単』
『こんなことに迷ってたとは、、』
○○エネルギーの時は、左辺に書いたら
それを右辺に移行したら符号は負になるってわけだ!
簡単すぎる!!
実際これを知らずにいちいち考えている受験生を哀れみながらあなたは、1分以内に方程式をたてればいい!
なぜ熱は熱量を放出しエネルギーは吸収するのか?
まあ、いままでのところで何となく、テクニック的に符号を覚えてもらいましたが、ここではなぜ熱は放出なのか?エネルギーは吸収なのか?という事を話して理解を深めておいてもらおうと思います。
まず、熱ですが、これは下向き矢印ですよね。ということは、最初にのべたように上に行くほど不安定でエネルギーが高くなります。下に行くほど安定してエネルギーが低くなります。
つまり、基本的にみんな下に行きたいんです!
イメージをつけてもらうと、ディズニーランドはお金を払ってでも行きたいですよね。
エネルギー図での下はディズニーランドのようなところです。なので、お金を払ってでも行きたいところです。
しかし、上はどうでしょう。不安定で、あまり行きたくないところです。だから、お金を貰わないとやってられないんです。
ゴミ処理の仕事などは給料が良いと聞きますが、それはみんなやりたがらないからお金を貰えるから仕方なくやっているのです。
つまり、エネルギー図でいう上は熱量をもらわないと行ってられるか!ということです。
エネルギー図の下はディズニーランド、上はゴミ処理場みたいな感じで覚えておき、そしてお金を考えるとなぜ熱は熱量を放出するのか?エネルギーは熱を吸収するのか?というのがイメージしやすいです!
特殊な熱化学方程式
熱化学方程式には特殊なパターンが
あります。
それは、1つの熱化学方程式が
2つの意味を表すのです。
これは知識として持っておいてください、
この知識は、ノーヒントで、
問題で使わなければならない事が、
あります。
なので、キッチリ覚えておいてください。
それは
2つあります。
その2つとは、
水の生成熱=水素の燃焼熱
CO2の生成熱=炭素の燃焼熱
この関係性なのです
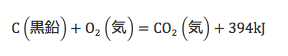
これはCを中心に見れば、燃焼熱
CO2を中心に見れば、生成熱を
あらわす熱化学方程式ということに
なります。
これもH2を中心に見ると燃焼熱
H2Oを中心に見ると生成熱を
表す熱化学方程式となります。
問題の解き方
とは言ってもこれだけわかっても「使いこなせるかな〜」とあなたは思われているかもしれない。
なので少し演習しておきましょう!
熱化学の問題の解き方はワンパターンなので、これさえ覚えれば、あなたが今後難しいと思うことは一切ありません。
STEP1 6個のエネルギー準位から必要なものを選ぶ!
問題文に「生成熱」とあれば、
「単体」、「化合物」が必要。
「燃焼熱」▶︎「完全燃焼」が必要
「結合エネルギー」▶︎「原子(気)」が必要
のようにエネルギー準位を選びます。
STEP2 図から足し算、引き算で熱量を求める。
ではこのやり方を
例題で確認してみましょう。
例)C(黒鉛)の燃焼熱:394kJ/mol、CO の燃焼熱 283kJ/mol、 CO の生成熱は?
▶︎まず問題文に『生成熱』『燃焼熱』がある。
つまり、「単体」「化合物」「完全燃焼」が必要!
そしてエネルギー図を書きましょう!
まず必要なエネルギー準位を書き出します。

そして矢印を書いていきます。
生成熱は○○熱だから下向き矢印、
矢印を書き入れたエネルギー図がこちらです。
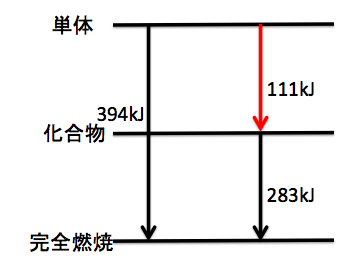
CO の生成熱は 111kJ/mol
とても簡単です。
熱化学の問題は多少難しくなろうと、
きっちり図を書ければ必ずできます。
熱化学の問題ではもう難問はありません。
[quads id=5]補足
様々な受験生にいただいた質問にお答えしていきます。
溶解熱は○○熱が負?

溶解熱が負になる問題がありました。○○熱が負ってことは、矢印が上向きになるってことですよね。
これって○○熱じゃなくて、○○エネルギー何じゃないですか?
これは、〇〇熱だったとしても値が負になることがあるんです。
また、溶解って「水とくっついてもいるけどそもそもバラバラになってもいるよね。」
水和熱、イオン化エネルギー、、、、
またギブズの自由エネルギー、
エントロピーなどを
色々考慮したうえで考えなあかんねん。
なので、溶解熱は負になることも
あるんやね。
ひとまず高校の段階では、
○○熱だから下向き、
それが負であるから、
エネルギー図で矢印が
上向きになる
と覚えておいて!
電子親和力はどう扱う?


じゃあ解けないのか?というとそんなわけない!
電子親和力は、

この図のように、単体の原子(Cl)1molと電子が『くっついて』陰イオンになることで放出される熱量です。
『くっつく』ということは、熱化学方程式は『右辺』で、エネルギー図の矢印は『下向き』ととらえればいい。
ということは、電子親和力は、『○○熱』として扱えば良い! まあこの混乱は、英語の『electron affinity』の日本語翻訳ミスですね。
あなたは、『電子親和熱』と覚えればオッケー!
それでは最後まで読んでいただきありがとうございました。
エネルギー図はまずは自分で作ってみる事が大事です。
こちらの記事で確認してください。
[quads id=5]
















なぜ下向きなら右辺と覚えるのに、○○熱は左辺にQKJとかくということなのですか?
○○エネルギーを右辺に書いて移行するとマイナスになるのはわかったのですが
下向き矢印なら右辺です。○○熱なら右辺に書きます。
なぜなら発熱反応だからです。
左辺の物質が右辺に行くときに熱を放出するからです。
○○エネルギーなら上向き矢印で左辺に書きます。
吸熱反応だからです。
より高いエネルギー状態に行くには外部からエネルギーを加える必要があります。
左辺の状態から右辺の状態に行くのにエネルギーが必要だから左辺にエネルギー量を書きます。
『記事の該当部分』です。
水蒸気の生成熱は( )kJである。(H-H,H-O,O-Oの結合エネルギー:436kJ,463kJ,498kJ)[3桁]
これを解いてみてもらえませんか?
近い問題がこれです。
問題の矢印を書き加えた図が良く分からないです。赤色矢印が111kjだと思ったのですが違うのですか?なぜ、右側の黒矢印が111kjになるのでしょうか?あと、生成熱は吸熱も発熱もどちらもありますよね?吸熱のエネルギー図だと、単体の位置から上向きに矢印が向きますよね?そうなると、あなたのどこからどこの図から見ると、結合eなどになってしまいませんか?
そうですね、黒矢印は間違ってます。なんでここ書いたんでしょうね笑直しておきます。
そして、 生成熱に関してですが吸熱反応だろうと入試問題では、負で与えられますので気にせず下向き矢印にしてしまえばいいのです。
こういうかんじ。
上が、実際のエネルギー図で
下が、なかむら流の考え方です。
負の熱量でも関係なくエネルギー図を作ると
-(-Q)=+Qとなり、
上とまったくおなじになります。
状態変化のエネルギーについて質問なんですが、凝縮熱はバラバラから塊になるので、下向き矢印にするんですか?それとも状態変化のエネルギーはすべて上向きですか?
このエネルギー図法は最初熱化学が苦手な人向けに
とっかかりとして作っていますので、
例外もあります。
そしてそれの1つが状態変化の○○熱ですが、
これはバラバラからくっつくが○○熱扱い
くっついた状態からバラバラになるのが、
○○エネルギー扱いです。
詳しくはこちら
間違えました。エネルギーではなく、熱です。
こんにちは。
なかむらさんの解法を見ながら、他の問題を考えていたのですが、なかなかうまくいきません。
このページに載っている例題は、かなり簡単なやつだと思うんですが、もう少し複雑な問題で見せていただけるとありがたいです。
こんなんとか
https://xn--qck0d2a9as2853cudbqy0lc6cfz4a0e7e.xyz/thermochemistry1
こんなんもあります。
早稲田の格子エネルギーの問題です。
https://xn--qck0d2a9as2853cudbqy0lc6cfz4a0e7e.xyz/crystal-lattice-energy
返信ありがとうございます。
さっそく解いていたのですが、エネルギー図が見れません、、、
スマートフォン(iPhone)から見ているのですが、普通に閲覧出来ますか?
普通に表示されてます。
PCから見ていただくなどしてください。
中和熱はどこからどこまでですか??
化合物で2レベル作って
化合物1
ーーーーーー
化合物2
ーーーーーーーー
と言う感じになります。
格子エネルギーって、イオン結晶を気体状のイオンにバラすのに必要なエネルギーですよね?
そうしたら、図の矢印が原子までではなくその上のイオン(気)までのような気がするのですが。
本当ですね!ご指摘ありがとうございます!
Na(固)=Na(気)-89kj①
Na(気)=Na+(気)+e- -496kj②
Cl2(気)=2Cl(気)-244kj③
Cl(気)+e-=Cl-(気)+349kj④
Na(固)+1/2Cl2(気)=Nacl(固)+413kj⑤
( )⑥
NaCl(固)の格子エネルギーQ(kj/mol)として(Q>0)⑥式の熱科学方程式を書きQを求めよ
これのエネルギー図の書き方を教えてください。複数の式に同じもので違う係数のものなどいっぱい出てきてゴチャゴチャでどう書けばいいのかわかりません。
答・・・NaCl(固)=Na+(気)+Cl-(気)-Q
Q=771(kj/mol)です
こちらで解説しています!
https://xn--qck0d2a9as2853cudbqy0lc6cfz4a0e7e.xyz/theory/how-to-write-ezu#i-5
炭素、水素、メタンの燃焼熱はそれぞれ394kJ/mol、286kJ/mol、891kJ/mol
メタンの生成熱は?
という問題も図で解くことはできるのですか?
楽勝でかけます
C、O2、H2は原子のところに書くのですか、それとも単体ですか?
全部同じ段に書くのですか?
もちろん、単体です。
そして、CとH2は同じところに書いて大丈夫です。
そしてCO2とH2Oを
完全燃焼の所に書いてください。
そうすれば出来ます。
塩化ナトリウムと水酸化カリウムを反応させたとき
硫酸と固体の水酸化カリウムを中和させたときの反応はどう書けばいいですか?
化合物レベル1から下向きに化合物2を書けば良いです。
わかりやすい説明ありがとうございます。結合エネルギーについての問題でわからないところがあったので質問させていただきました。
アセチレンの生成熱が-232kJ
H-H,C-Hの結合エネルギーがそれぞれ436kJ,415kJ、黒鉛の昇華に必要な熱量が713kJの時、アセチレンの三重結合の結合エネルギーを求める問題です。
この問題をエネルギー図で解くなら、どのような図になりますか?自分で書いたのですが、上下がわからなくなりました。
よろしくお願いします。
結合エネルギーに関する記事は
こちらにあります。
かなり近い問題も多くそろえてありますので、
こちらでご確認ください。
https://xn--qck0d2a9as2853cudbqy0lc6cfz4a0e7e.xyz/theory/how-to-write-ezu#i-4
陰イオンが原子よりも下ってことは図的にも下に書けばいいんですか?
イオン化エネルギーって大きいほど陽イオンになりにくいって書いてあるんですけど、図の場合でも上にいくほど陽イオンになりにくくなりますか?
そうすると、陰イオンの位置がわからなくなりました
よろしくお願いします。
上から陽イオン、原子、陰イオン、
イオン化エネルギーが大きい=原子と陽イオンとの間が広い
反応熱を熱化学方程式から組み立てるときはどうしたらいいですか?
私が解いた問題は答えにマイナスが
ついててエネルギー図の書き方が
分かりません。
どうしたら求められますか?
エネルギー図で熱量が負ということは、
上向き矢印です。つまり左辺がした右辺が上に
書くと言う事になります。
ブドウ糖をアルコール発酵させると、以下の反応式にしたがってエタノールが生成する。
C6H12O6(固)=2C2H5OH(液)+2CO2(気)+Qkj
ブドウ糖とエタノールはどちらの方がエネルギーが高いですか?
化合物が2つ以上ある時のエネルギー図がわかりません。
こういう風に、
どちらが上か下か迷うときがありますよね。
こういうときには、
どうすべきか、
それは、まず+QkJと書いてあるので、
○○熱だと思ってエネルギー図を書きます。
そうすると、どうでしょうか?
とりあえずは、上に
グルコースを書いて、
下にCO2+エタノール
を書くのがわかります。
こうすれば、
本当は、エタノールとCO2が
上でないと行けない場合は、
Qが負の値になります。
あ、負の値が出たら、
「逆だったんだな〜」
って思えば良いだけです。
別に対して気にする必要はありません。
なるほど✨ありがとうございます!
私はこのサイトのおかげで気体の問題や化学平衡の問題が解けるようになって、偏差値が15上がりました。
無機有機高分子の方も増えると嬉しいです!
マジですか!それはうれしいですね!
これからもガンガン使ってって下さい!
酸素の燃焼熱ってありますか?2014年のセンター過去問を解いていたら気になったので教えてください。
さすがに、それは無いと思いますよ。
蒸気熱って図のどこからどこに書けばいいのですか?
こちらに、蒸発熱に関してかいてあります。
https://xn--qck0d2a9as2853cudbqy0lc6cfz4a0e7e.xyz/theory/thermonic
アンモニア、一酸化炭素、水(気)の生成熱はそれぞれ46kj/mol、-90kj/mol、242kj/molである。アンモニア4molが酸素と反応して、一酸化炭素と水(気)が生じる反応の反応熱を求めよ。
という問題があるのですが、これってエネルギー図で解けますか?解答を見ると-90×4+242×6-46×4=908kj
となって矢印がアンモニアだけ上向きになっているのですがどういうことでしょうか?
ごめんなさいわからない場所が何なのかがわかりました。一酸化窒素がマイナスなので上向き矢印ということはこれをエネルギー図すると
アンモニア:単→化
一酸化窒素:化→単
水:単→完
求める反応熱:化→完
だと思うのですが、ここからどう引けばいいのかわかりません。これはベクトル向きの足し算のようにして解くのですか?
質問です。
CH4O(液)+3/2O2=CO2+2H2O(液)+726kj
この熱化学方程式はエタノールの燃焼熱、二酸化炭素の生成熱のどちらが正しいですか?
燃焼熱ですね。
生成熱は単体から作り出される事です。
そして、CH4Oはメタノールですね。
CH4+H2O(気)=CO+3H2+Q kJ
これをエネルギー図に表すにはどうすれば良いですか?
右辺に化合物COと単体H2があるので手が止まってしまいます、、、
できれば図に書いて教えていただけたら幸いです。
左辺が上で右辺が下です。
-QkJと書いてあれば、逆です。
◯◯熱なら左辺が上、右辺が下という原則です。
もし、本来右辺が上ならば、
求めたときにQが−の答えになるだけです。
重問2017のB問題で、2016九州大の問題らしく、解答に代入法しか載ってないうえに、問題も新しいのでどこのサイトにも載ってません。もしよろしければ教えていただけませんか?
丸2日ほどこの問題で考えたのですが、エネルギー図が書けません。お時間があるときに是非お願いします。
Fe2O3、CO2の生成熱は、それぞれ824kJ/mol,394kJ/molとする。また、次の反応により1molのFe2O3を還元する反応は25kJの発熱とする。Fe2O3+3CO→2Fe+3CO2
次の反応熱Q1,Q2を求めよ。
Fe2O3+3C=2Fe+dCO+Q1
C+(1/2)O2=CO+Q2
です。よろしくお願いします。Q1=-491kJ Q2=111kJです。
https://xn--qck0d2a9as2853cudbqy0lc6cfz4a0e7e.xyz/theory/e-zu-mendoi
うおおおお!気づきませんでした。
ありがとうございます!!
いえいえ!
2017年長崎大の問題なのですが、
メタンの燃焼 CH4+2O2=CO2+2H2O(液)+890kJ
水素の燃焼 2H2+O2=2H2O(液)+572kJ
水素は、一般的にはメタンと水蒸気から、以下の反応により
製造される。この過程では二酸化炭素が生じる。この水素製
造法を水蒸気改質という。
CH4+H2O(気)=CO+3H2-210kJ
CO+H2O(気)=CO2+H2+QkJ
QkJを求めよ 水の蒸発熱を40kJ/molとする。
このエネルギー図が書けません。塾の先生はこの手の問題は代入法で解くとおっしゃっていたのですが、エネルギー図は使えないのでしょうか。教えていただきたいです。お願いします。
2C(黒鉛)+2H2=C2H4-Q(kJ)
は生成熱なのにどうして-Qなんですか?
エチレンのほうがエネルギーが高いからです。
物理でもエネルギー図がでてきたのですが化学と同じように適用できますか?(核エネルギー、質量エネルギーなど)
例題で実際に図を書いてみるととただ引き算すればいいだけ!
っていうのがすぐ分かりました!
C+o2=co2+394
H2+1/2o2=H2o+286
CH4+2o2=co2+2H2o+891
メタンの生成熱を求めろという問題なんですが、2段目の式を二倍するような数あわせはエネルギー図だけ書いていてもわからないのですがどうればいいでしょうか?
メタンの生成熱何だから水素が2mol必要なことは式を見なくてもわかります。
こんにちは。初歩的な質問いいですか?補足の電子親和力について単体(Cl+e-)からイオン(cl-)に下矢印を引くことはできるんですか?そもそもCl+e-が単体として扱わないのですか?
出来ます!
単体ではなく原子のミスです。
原子(気)やイオン(気)って書いてありますけどなんのことだかよくわかりません。なぜ単体と原子でわけているんですか?化合物が分解されたら単体になるんじゃないんでしょうか?
希ガス以外で原子だけで単体として成立しているものはありません。
なぜ硝酸カリウムを水に溶かすと水和するのに熱が吸収されるんでしょうか。
高校化学で説明できません
なぜサリチル酸のcoohと無水酢酸は反応しないのでしょうか
エネルギー図を使わず 化学式を代入する。という方法で解くことができない問題を貼ってくれませんか。
https://受験理系特化プログラム.xyz/thermochemistry1
(4)Q=-120となっていますが、
Q−210=(890+40×2)−570×2
∴Q=40
では?
一酸化炭素と水蒸気の反応は、
やや発熱で、水性ガスシフト反応というそうです。
蒸発熱の取り扱い方が分かりません。
ZnCl2とHClのそれぞれの生成熱と水への融解熱がそれぞれあるんですが、これらを使って亜鉛を塩酸に溶かすときの反応を熱化学方程式で示す問題を図で表すにはどうしたら良いですか?
NH3aq+HClaq
↓
NH4Claq ↓
↓
NH4Cl(固)+aq
この3つのエネルギーの大小関係はあっていますか?同じ水和物(という言い方で合っているのかわかりませんが)というもの中でも、くっついているものほど下にという考え方で合っていますか?
問題を解くためにエネルギー図を書こうとするとき、どこから手をつけたらいいかわからなくなります。はじめ、求めたいもののエネルギー図をかいてそこから手をつけようとすると、何を書き足せばいいのかも分からなくなるし、じゃあ違うところから描き始めるのなら、何に目をつければいいのかわからなくなります。コツはありますか?
エネルギー図で解けない問題はありますか?
まあ、割に合わない問題はあります。
エネルギーは、単体>化合物の順に書くと説明されていますが質問です。
例えば、エチレン(気)の生成熱は −52.5kJ/molですが、このようなときでも、化合物であるエチレンが下になり、上に書くのは、CとH2なんでしょうか?
そうです。
マイナスで与えられているので、マイナス符号のまま下向き矢印書けばOkです。
問題を解けばわかりますが、燃焼熱などをどうせ与えられるので、結果的にCとH2が上にいた方が楽に解けることが多々あります。
返信ありがとうございます。
http://www.toshin.com/center/2019/q/kagaku.pdf
2019年のセンター試験2-1の質問です。エネルギーの高さは、単体>化合物の順とのことだったので、私はアには単体が入ると思い、すぐに④~⑥にしぼれるなと思いました。
過酸化水素の生成熱が136kjなので、
H₂+O₂=H₂O₂+136kj
という式が作れますよね。この式からもH₂+O₂のもつエネルギーの方が高いこともわかります。
ただ、もし、過酸化水素の生成熱が-136kjだったとしたら、
H₂+O₂=H₂O₂-136kj
となり、H₂O₂のもつエネルギーの方が高くなり、アに化合物であるH₂O₂がくるんじゃないでしょうか?
生成熱が負になる場合でも、アの位置には、必ず単体がきて、イには化合物が来るんでしょうか?
この場合は、化合物の方が、単体よりエネルギーが高いのに、イの位置に書いてもOKなんでしょうか?
問題は詳しく見てません。
>もし、過酸化水素の生成熱が-136kjだったとしたら、
>H₂+O₂=H₂O₂-136kj
>となり、H₂O₂のもつエネルギーの方が高くなり、アに化合物であるH₂O₂がくるんじゃないでしょうか?
これはその通りです。
1つ前の返信は計算問題を解く前提で話をしています。
じゃあ、実際にエネルギー図でどっちが上なのか?
と言ったら、吸熱反応ですからH2O2の方がエネルギーが高いです。
この記事に書いてあることは、あくまでエネルギー図で計算を解くときには、単体>化合物という順で解けば良いのであって、2019年のようなエネルギーの高さを調べる問題は、必ず単体>化合物の順になるとは限らないという認識でよろしいでしょうか?
その認識は主語が大きすぎますね。
バラバラな方が上、くっつくと安定で下 これは一般論として正しいです。
ただ過酸化水素のような不安定な物質の場合はH2より不安定で上に来る場合があります。
また、この場合は「これは吸熱反応だから上向き矢印だな」と、この記事の知識で解説している内容からエネルギー図は作れるはずです。
この記事の全てが計算のためだけに書いているわけではないです。
すみません、訳がわからなくなってきたので、まとめたいのですが、
①エネルギーは、単体>化合物の順にならないことがある。
②エチレン(気)の生成熱は −52.5kJ/molですが、正しいエネルギー図を書くときは、エチレンが上になる。
③エネルギー図を使って、計算する場合は、②の場合でもエチレンを下にして計算してもよい。
①~③は全部正しいのでしょうか?
はい
生成熱が吸熱反応ときには、化合物>単体の順になり、矛盾が出ますが、
この記事で、単体>化合物の順にしているのは、一般にエネルギーが、単体>化合物の順になることが多いからですか?
それとも、計算する上で、この順だと都合が良いからですか?
両方です。