こんにちは。
このページにたどり着いて人は、
おそらく、もうそろそろ
理論化学も終盤なんでしょう。
ついに化学平衡にたどりついた、
でもルシャトリエの原理の説明で、
具体例ばかりでなんか
イメージがつかない。
そういう人っていません?
俺はそうでした。
平衡状態は、よくわからんけど、
「反応速度が右向きと左向きで同じになるとき」
って覚えているだけでした。
だから、なんか
平衡移動の問題のパターンを
丸暗記なんかしてみたりして、
でも、
「やっぱりなんかイメージがつかないな〜」
と悩んでいる。
そういう人が多いと思います。
なので、この記事は、
ルシャトリエの原理が、
『本当はどういう事を表しているのか?』
っていう本質に迫りたいと思います。
目次
平衡状態とは何かの本質
まずルシャトリエの原理は、
『とにかく平衡状態にもどりたい』
っていう働きです。
平衡状態とは、
『もっとも安定な状態』
のことを言います。
そして、この安定な状態は、
『温度によって一定』なのです。
だから、平衡定数って一定ですよね!
部屋がどうやっても汚くなるのも、、、

受験化学コーチなかむらの部屋や机は
常に汚いです。
毎月1回必ず掃除します。
そしてメチャクチャ綺麗にします。
高校生のときからそうでした。
何かの拍子にいったん掃除して
綺麗にするのですが、
いつの間にか、
汚い状態に戻ってしまうのです。

↓

もしかしたら、あなたの部屋もこんな感じかも知れません。
そして、平衡状態とは、
『汚くなった状態の部屋』
みたいな物なのです!
部屋は綺麗な状態は不安定で、
普通に過ごしていたら、
いつのまにかぐちゃぐちゃになりますよね。
自然界もそうで、
ぐちゃぐちゃな状態、
つまり、『乱雑』になるほうが、
安定なのです。
エントロピー増大則
ぐちゃぐちゃになる方が安定、
そして、どれくらいぐちゃぐちゃかを表す、
物理量があります。
それが『エントロピー』というものです。
高校の教科書は、発展で、
『乱雑さ』
って書かれてます。
エントロピーというのは
どれだけぐちゃぐちゃかっていうのを
表します。どれだけぐちゃぐちゃかというのを表します。
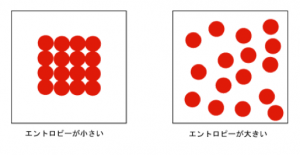
左のエントロピーは小さいですが、
右のエントロピーは大きいです。
自然界もワタナベの部屋も
どんどん『乱雑な方』へ向かいます。
つまり、左から右の状態になるわけです。
ということは、普通は、
『エントロピーは増大する』という
わけです。
これがエントロピー増大の法則です。
平衡状態のイメージは?
今回の記事は、
受験生にエントロピーを覚えてほしい、
わけではなく、
結局は、平衡状態ってのは、
『熱力学的に安定』な状態で、
温度によって固有の状態なんだよ!
そして、いろんな問題でもあるように、
外部から影響を与えられても、
また、新しい平衡状態に
なりたがるんだね!
って言う事です。
この記事では
受験テクニックってわけではないですが、
割と重要なイメージなので、
書いておきました。
平衡状態は、
きたねえ部屋だと思っておいてください!
どうでしたか?
平衡状態というのは、
非常に重要で、
これを理解する事が、
平衡の計算問題に非常に重要です。














分かりやすいイメージだと思いました。
この「平衡状態は汚い部屋!」のような「〇〇は△△!」という例えは脳に残りやすくて良さそうですね。
ありがとうございます。
これからも、こういうたとえとか
増やしていけるようにします。
単純な濃度、圧力、温度等の変化による平衡の移動はわかるんですが可逆反応の式にない元素(問題で見たことあるのはHe、Ar)を入れた時はどのように考えればいいのでしょうか。
混合気体の知識はありますか?
それによって説明の仕方が変わります。
混合気体っていうと分圧分体積のことですか?
分圧、分体積は知識としてはあります。
それ以外のことならば混合気体って言われて何も思い浮かばなかったのでわかってないかもです。
返信遅れてすいませんm(__)m
それでは、まず混合気体の扱い方を知ってください。
『混合気体』
どうしても化学平衡が理解出来ない場合はどの単元から復習するべきでしょうか?