こういう疑問にお答えします。
- 水和って化学的にどのような現象なんだろう?
- 硫酸銅五水和物はどのように「水和」しているのか?
- 「水和水」「水和物」のような用語がしっかり理解できる
なんとなく知っているって人が非常に多い分野だと思います。
きっちり理解するためにこの記事をぜひ最後まで読んでください。
※2分ほどで最後まで読めますので、関連記事も読んで見てください。
目次
水和とはどんな原理なのか?

水分子が粒子を結合で取り囲むこと。
水に溶けるとき、溶質粒子を水分子が取り囲んで引き剥がしていきます。
この時の取り囲む現象を「水和」と言います。
言葉ではよくわからないと思いますので、「水に溶ける」という現象を詳しくみていきましょう。
+ーが書かれているつぶつぶをイオン結晶のNaClあたりだと思っておいてください。

このように、端っこの粒子から水分子で取り囲みます。水分子はHとOで電気陰性度に差があります。
なので、陽イオンとは、Oの非共有電子対が、陰イオンとは、Hのδ+が静電気的な引力で引き合います。
すると、このように引力でくっついたものが引き剥がされます。
そして水がまとわりついた粒子は、熱運動で元の結晶から離れていきます。
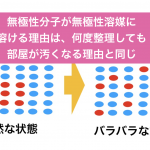
このようにして、どんどん溶媒の中でバラバラに引き離された状態が「水に溶ける」という状態です。
そして、水和とは、水分子に極性の引力でくっつかれて、取り囲まれた状態のことを言います。


こういう状態が水和です。
水をヤンキーに例えると、

友達と歩いていたら、

ヤンキーの水分子に取り囲まれ(この状態が水和)

引き離されて水に溶けるのです。
つまり、水に溶けている時点で「水和」しているのです。別にイオンだけでなくて極性のある分子も水和します。

このように、エタノールなんかも水に水素結合でまとわりつかれます。これも水和です。
ちなみに、この水和している水分子のことを水和水と言います。
水和水を持つ硫酸銅五水和物はどういう状態?

水和物といえば、高校化学で一番有名なのは硫酸銅五水和物でしょう。

と思うかもしれません。
硫酸銅五水和物は、下の構造のように水分子が完全に「化学結合(配位結合)」をしています。

どういうことかわからないですか?
では、もっとズームアップしていきますね。銅と水分子の平面構造だけ見ていきます。

これです。銅イオンCu2+の周りに4つの水分子が配位結合しているんです。なので、水に溶けずに結晶の中に水分子が取り込まれています。
このように水和水が結晶に取り込まれているものを「水和物」と言います。
一旦補足で化学結合の話を挟みますが、続けて水和物の話もしていきます。
ちなみに、化学結合は、共有結合とイオン結合と金属結合のことを言います。また配位結合は結合してしまえば、共有結合と見分けがつかないため、化学結合の1種と扱われます。
高校化学では、便宜的に3種類に分けられていますが、本当のところは全て共有結合です。これらを電気陰性度の差で区別しているのです。
このことを理解すると、ハロゲン化銀ではぜフッ化銀だけは水に溶けるのに、他は沈殿するのか? などの本質的理解をすることができます。
↓詳しくはこちらの記事↓
ちょっと間が飛びましたが、水和物の話を続けていきます。

そう思っているでしょう。それでは、ここから硫酸銅五水和物ができていく流れをご覧ください。

先ほどの[Cu(H2O)4]2+に対して、SO42-が再び配位結合をしていきます。
Cuの上下に配位結合をしていきます。
これでも、まだH2Oが足りませんよね。てな訳でここから解説していきますよ。
最後の残り1つ足りない水は、硫酸銅の4つ水分子が配位結合しているもので共有するのです。

このように、間に水分子が水素結合で挟まります。これが5個目の水分子なのです。

そう思うかもしれません。ですが、SO42-は上下の銅イオンで共有されていると考えます。なので、片方の銅イオンと配位結合しているSO42-は、1/2個だと考えます。

なので、SO42-は1/2ずつなのでそれが2個で1個と考えます。水素結合で挟まれている水分子も上下で1/2個ずつと考えると、1個です。
よって、硫酸銅五水和物、CuSO4・5H2Oとなるのです。
ちなみに、硫酸銅五水和物と言えば、ほぼほぼ間違いなく「固体の溶解度」の問題が出題されます。
CuSO4・5H2Oで溶質はどこまでなのか? 5H2Oは溶媒として扱うのか?
などきっちり理解していない人が多いため、しょっちゅう狙われる問題です。なので、この機会に確実にマスターしておいてください。
まとめ
- 水和とは水分子が粒子の周りに結合してまとわりつくこと
- 水和水が結晶に入り込んでいるものを水和物という。
水和・・・水分子が静電気的な引力で取り囲むこと
水和水・・・水溶液中や結晶中で、分子またはイオンと※強い相互作用で結び付いた水分子の総称。
※強い相互作用とは、極性による静電気的な引力のこと。配位結合も含む
水和物・・・ 水和水を持つ結晶
錯イオン・・・金属原子に配位結合で繋がったイオン。