かれこれ半年くらいアンケートを取っているんですが、溶液の分野が苦手な人って多いですよね。
ヘンリーも苦手だし、溶解度も苦手だし、今日の分野もみんな苦手です。
なので、この記事で、凝固点降下、沸点上昇の計算だけでなく、
そもそもなんで凝固点降下とか、
沸点上昇が起るのか?
っていうところまで話して、
完全なる理解を
してほしいと思います。

目次
凝固点降下、沸点上昇が起る理由
凝固点降下と沸点上昇って
真逆っぽいイメージですよね。
でも実際は、
『同じ理由』でこの現象が
起っているんです。
沸点上昇、凝固点降下が起る人混みが邪魔効果とは?
実は、この2つは、共通していて
人混みが邪魔で目的地に
たどり着くのが遅くなると言う
現象です。
どういうことかというと、

この人に着目してください。
この人は、

矢印の方向に進みたいとします。
でも、人混みで、邪魔ですよね。
ガンガンあたってしまいます。
周りの人が居なかった場合に
比べて、だいぶ目的地につくのが
遅れます。
これです!
凝固点降下と沸点上昇の
教科書の書き方と言うのは、
次のようなモノになります。
溶液の凝固点が、純粋な溶媒の凝固点に比べて、低くなる現象。溶液の凝固点では、凝固し始めるのは溶媒だけ!
溶液の沸点が、純粋な溶媒の沸点に比べて、高くなる現象。ただし、溶質が不揮発性の物質であるときに起る現象!
かなり難しく書いてあるから、
よくわかりませんが、
例としてNaCl水溶液を出すと、
まず、水だけの場合、
凝固するのに、特に問題は
無いですよね。
水分子がどんどん集まって、
凝集して、固まって行く
わけです。

でも、NaCl溶液だとどうでしょうか?
Na+とCl–が
解けている事で、
固まるときに邪魔になりませんか?

これってまさにさっきの人が
じゃまで目的地まで行くのに、
時間がかかる効果ですよね!
塊に行きたいけど、
溶けているイオンが邪魔で、
なかなか塊まで行けない!
これが、凝固点降下です。
だって、普通の凝固点では、
なかなか凍らない、だから、
もっと温度を下げないといけない!
てことは、
凝固点がもっと低い温度になる!
凝固点降下してるやん!!!!
全く同じ理由で沸点上昇も
わかります。
もちろん、溶けているイオンが
『多い方が邪魔ですよね』
二子玉川よりも、
渋谷の方が目的地に進む
スピードは遅くなります。
(にこたまに何の恨みもありません)
沸点上昇というのは、
不揮発性の物質が溶けているときに
使える技でした。
沸点上昇も同じように
考えれば良いのです!
純水は沸点は100℃です。
なので、100℃になると、
水分子が外に出て行きます!
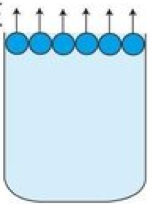
でも、これにNaClが溶けていたら、
どうなるでしょうか?

この赤玉がNa+やCl–です。
水分子が空気中に出て行こう!
としているのに、
NaClが邪魔で行けないですよね。
これってさっきの人混みで
目的地に進むスピード遅くなる
効果ですよね!
だから、もっと蒸発させるために、
温度を上げないといけない。
沸点上昇しとるやないかい!!!
これが沸点上昇です!
先ほどの渋谷と二子玉の例え、
と同じように、
溶けているイオンが多いほど、
沸点上昇は大きくなります。
めっちゃ簡単!
では、これを計算でかくにんしていけば、
もう勝ちですよね!
こんな感じで、純水みたいな、
純溶媒に不揮発性溶質を溶かすと、
純溶媒よりも凝固点は低くなり、
沸点は高くなります!
凝固点降下、沸点上昇の計算!
それでは、
凝固点降下と沸点上昇の
計算ですが、
メチャクチャわかりやすい
公式をおぼえれば、解けます。
ありがたい事に、
凝固点降下も沸点上昇も
同じ式を使う事が出来るのです。
その公式は、
(温度変化)は溶質の質量モル濃度に比例する
という公式になります。
この公式は、高校生では、
証明できないので覚えておいてください!
このm:質量モル濃度は
単位が重要です。
このように、単位は

となります。
分母は溶媒の質量ということに
注意してください!
そして、このKは比例定数で、
『溶媒によって決まった値』を持ちます。
Kの値は、濃度が1mol/kgの時の
ΔTなので、
モル凝固点降下やモル沸点上昇といいます。
それぞれKfやKb
と表します。
f:freezing point=凝固点
b:boiling point=沸点
まあ見ての通り、
あまり説明する事が無いくらい
簡単なんです。
注意する事と言えば、
次に説明するつぶつぶの数に
比例すると言うことだけ
ちゃんとわかっていれば大丈夫です!
つぶつぶの数に比例して大きくなる
凝固点降下や沸点上昇って
さきほども言ったように、
二子玉のような田舎より、
人の多い渋谷の方が大きい。
てことは、
電離している方がより、
『邪魔』なわけです。
これは、完全電離するHClの方が、
CH3COOHよりも、
凝固点降下度や、沸点上昇度が
大きいわけです。
水溶液中で電離する奴って、
『1molで2mol分邪魔してくる』
わけです。
また、他にも、
会合と言う現象もあります。

酢酸が分子内水素結合で
2分子で1分子のように
ふるまいます。
会合しているぶん、
邪魔が減ります。
このように、電離したり、
会合したりで、凝固点降下度が
変わってくる事があります。
それを分類して学んで行こうと
思います。
溶質が強電解質の場合
例えば、NaClの場合、
水溶液中では、受験的には、
完全電離と見なせます。


このような収支表を書くと、
電離後3倍の質量モル濃度に
なっている事がわかります。
全粒子濃度は2a(mol/kg)となります。
すると凝固点降下度は、全粒子濃度に
比例するので、

となります。
他にもCaCl2を見て行きましょう。
CaCl2は溶液中で、電離して、

の用になります。
CaCl2の質量モル濃度をb
とすると、
全粒子の濃度は、3bとなります。
これにより、凝固点降下度は、
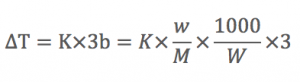
となります。
溶質が可逆的に電離する場合
例えば、酢酸ですが、
酢酸は、弱酸ですので水で完全に電離
しません。
次のように一部だけが電離します。
だから、電離前の酢酸の
質量モル濃度をCとして、
酢酸の電離度をαとすると、

よって電離後の全粒子濃度は、
C(1+α)mol/kgとなります。
すると凝固点降下度(沸点上昇度)
は、全粒子濃度に比例するので、
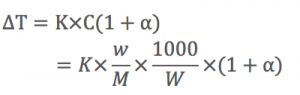
となります。
また、逆に、この凝固点降下度
沸点上昇度がわかれば、
電離度もわかります。
会合する場合
酢酸をベンゼン溶液に入れたときを
考えます。
酢酸は水には溶けますが、
有機溶媒(今回は、ベンゼン溶液)には
溶けません。
これは、似た者同士よく溶ける
と言う考え方です。
これより、
似た者同士よく溶けます。
酢酸はカルボキシ基がある
おかげで、極性があります。
このため、極性溶媒の水には、
よく溶けます。
でも極性の無い無極性溶媒の、
有機溶媒には溶けにくいのです。
ということは、酢酸は
電離しません。
そしてカルボキシ基があることで、
一部の酢酸同士が、
『会合』します。

このように会合すると、
2粒なのに、1粒かのように
振る舞います。
ということで、会合前の酢酸の濃度を
Cとし、酢酸の会合度(会合する割合)を
βとすると、

と言うようになります。
これより、
凝固点降下度、沸点上昇度は、

となります。
まとめると
粒子数を補正するために
ΔT=iKmとおくと、
| i | 溶質の例 | |
| 非電解質 | i=1 | グルコース |
| 強電解質 | i=2 | NaCl,HCl |
| 強電解質 | i=3 | CaCl2 |
| 弱電解質 | i=1+α | CH3COOH |
| 会合する溶質 | i=1-1/2β | ベンゼン中の
カルボン酸 |
凝固点降下ってこんなところでもわかる

これ見た事あると思います。
これ凍結防止剤ってやつで、
冬場によくみますよね。
雪の前日とかに
道にばらまかれるやつ。
CaCl2は潮解性があり、
水を空気中から奪います。
すると、CaCl2水溶液になり、
凝固点降下で道路が凍結
しにくくなります。
またCaCl2は溶解熱を
発生させるので、
凍結しにくいと言う効果もあります。
凝固点降下や沸点上昇は溶質の分子量測定に使える!
ΔT=Kmのmは質量モル濃度である事を考えるとこれを変形すれば、分子量を求められます!
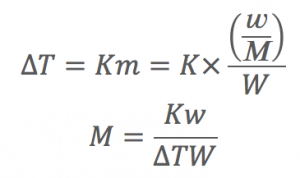
分子量を主に求めなければ、
ならないときと言うのは、
構造決定などです。
構造決定と言うのは、
分子式が無いと何も
出来ません。
まず分子式を求める問題があります。
このときに、分子式を求めるために、
組成式と分子量が必要です。
なので、構造決定でも
時々、沸点上昇や凝固点降下が
出てくる事もあります。
意外と計算問題も収支表を
書けば、簡単にできたり
します。
なので、恐るるに足らず、
他の分野でも、
難しいと思っているかも知れませんが、
案外
早とちりだったりします。
以上です。最後までご覧いただきありがとうございました。















なるほど
このサイトの全記事を理解したら高校化学の理論ってマスターできます?
このサイトの活用の仕方がイマイチわからなくてですね・・・
ここで完璧にすると言うより、
普段の学習の傍らに置いていただく
感じです。
重問を解くときとかに、
「こっちの解法の方がわかりやすそうだから、
やってみよう!」
って感じです。
なかむらさんが成績を上げた2週間にやったことを具体的に知りたいですね
まあカッコ良く裏ワザっぽく話してますが、
一気に化学に特化しまくった
勉強をしました。
短期間に集中的に
そしたら上がりました。
計算式のK×W/M×1000/Wが、何を表しているのかわかりません
基本的なことですみません
溶質と溶液でwを使い分けています。
わかりやすいです!
学校の先生から化学の問題の解説聞くよりも
このブログで似たような分野さがして理解した方が手っ取り早いなと思いました笑
ありがとうございます!
どんどん活用していってくださいね!
とても参考になりました*_ _)!!
ありがとうございます!!
ひとつだけ、小見出しが「溶質が今日電解質の場合」になっております…!
ありがとうございます!修正します!
見出し語が今日電解質になっているところがありますよ!
ありがとうございます!修正します!
電離した時のイオンの数だけ掛けるんですね
こんにちは。 理論化学の問題文の見方が大きく変わりました!感動してます!
会合のところで質問です。
北大の改問題でベンゼンと酢酸がピンポイントで出てきました。
酢酸の会合度を求める際、
『会合前の酢酸の濃度を
Cとし、酢酸の会合度(会合する割合)を
βとすると、』のCを、物質量molで計算しても良いのでしょうか。