どうも、受験化学コーチなかむらです。
化学で絶対に避けて通れないものに『モル』があります。化学の計算はまずモルに変換して行います。
それを私は、「モル利用」「モル比」と勝手に名付けて、
「理論化学の計算なんて簡単!2つの事を意識するだけで解ける!」でも書きましたが、
どんな問題もこの2つの方針で計算をしていきます。
そして、理論計算であらゆる場面で出現するのが『濃度計算』の問題です。
濃度計算は、
「それ自体が問題として出題される」
だけでなく、
「他の分野の計算問題」にも関係してくるのです。
『希薄溶液の計算』や『酸・塩基の中和の定量計算』の勉強をするときでも濃度計算が使われます。
濃度計算が出来ていないと、芋づる式にこれらの分野の問題も解けなくなります。

だから濃度計算は完璧にできて
おかないと
ヤバいです、、、
ですが、
実際は、、、、
モル濃度計算は超基本事項でありながら、
意外と苦手な人が多い内容となります。

今日は『ある方法』を知ることで、
『モル濃度からパーセント濃度への変換』
がどう見てもゴミにしか
見えなくなります。
そしてこの手の問題であなたの脳みそが稼働する事はなく、脳みそのブレイクタイムとなります。
なので最後までシッカリ読んでっておくんなさい!
[quads id=5]目次
濃度変換の問題が苦手な理由
濃度変換の問題が苦手な受験生は『頭』をつかって問題を解こうとしています。そう考えちゃうんです。だから解けないんです。
「は?どうしたんだ!お前普段は考えろ!って言うくせに」
まあ、そうなんですよ。ただ、この濃度変換に関しては、もはや考えることなんて一つも無いんですよね。『テンプレートに当てはめるだけ!』なんですよね。
どういうことか説明のためにひとまず例題を出していこうと思います。ちなみに悪い例から!
例)密度1.18g/cm3 の10%硫酸水溶液のモル濃度を求めよ。(H2SO4=98)
これはパーセント濃度からモル濃度へ変換すると言う問題です。まずは、苦手な人の思考パターンを再現します。





僕から言わせると、
『はい、遅すぎーーー』
僕ならもう解けてます。
「なんでそんなにはやく解けるんだよ?」
はい、それは、
『脳みそをこれっぽっちも使っていない』
からとなります。
しかし、得意な人ほど実は、『頭を使わずに計算している』のです。
今日はこの『得意な人のやり方』を苦手なあなたが出来るようにしていきます。っていうかこれを知って苦手なんてありえないですからね!一緒にテンプレートに当てはめていきましょうね!
とりあえず入試に出る濃度を覚えろ!
濃度計算は、濃度の単位を正確に覚えればもはや勝ったも同然なんです!
だから濃度をとっとと完璧に覚えてくだされ!
こちらに動画をとりましたのでこちらでご確認してください!

※ 1 h:補助単位でヘクトと読みます。
※ 2 密度は分子が溶質量ではなく
溶液全体の質量を表すのです!
この単位がきっちり覚えられていない人は、非常に混乱してしまいます。
例えば密度が表す質量が『全体の質量』である事など。この濃度の分野では、キッチリ全体の質量なのか、溶質の質量なのかを区別する必要が在ります。
質量パーセント濃度で「無水」と書いてあるのは、水和物が溶質である場合、水和水は溶質量に組み込まない!という風に覚えてください!
濃度変換の最強の方法!
それでは濃度変換方法を発表します。とても簡単に濃度変換計算をする方法なので手順通りに進めていってください。
要は、濃度計算って『単位を変換しているだけ!』なんですね!
先ほどの例題を使います。
例題)密度1.18g/cm3の10%硫酸水溶液のモル濃度を求めよ。(H2SO4=98)
この問題は、質量パーセント濃度からモル濃度変換問題ですね!まずこの二つの変換方法を教えます。しかし、この方法は別の単位変換にも使えるのでやり方をマスターしてください。
テンプレートに当てはめていくだけなんで、このテンプレートの書き方を覚えてくださいね!って言うほどのものでもないけど(笑)
手順①まずテンプレートを書きます。

この写真と同じ図を書いてください!
手順②左に変換前の濃度の単位を書く。

先ほど覚えた質量パーセント濃度を左に書きます。
手順③右に変換後の濃度の単位を書く。
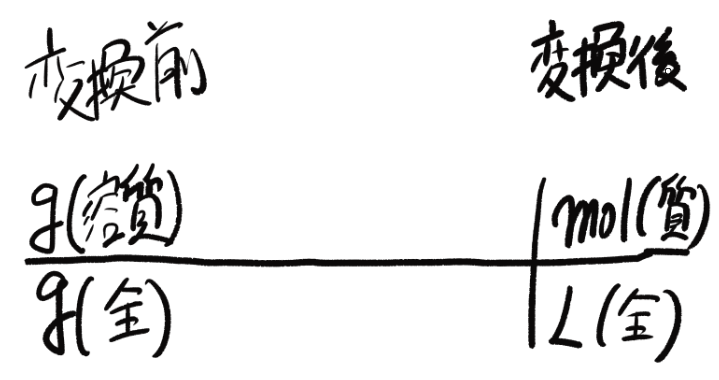
この問題は%濃度をモル濃度に変換する問題だからこのようになりますね!
手順④分子と分母別々に変換する。

※ここが最重要ですよ!濃度って、パーセント濃度をモル濃度に変換しているように見えてるけれども溶質の質量をmolに!そして、溶液の質量を溶液の体積に変換しているだけ!なのですよ!
Aに何かを掛けてBにする場合どうしますか?脳みそ使わなくても分かります。
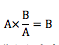
であることくらい小学生でも分かります。
これを使うのです。

分子は分子、分母は分母それぞれで変換されているのがわかるでしょうか?分子、分母を別々に変換していくのが濃度計算の基本です。
あとは、これに当てはめるだけなのです!
それでは具体的に代入していきましょうか!
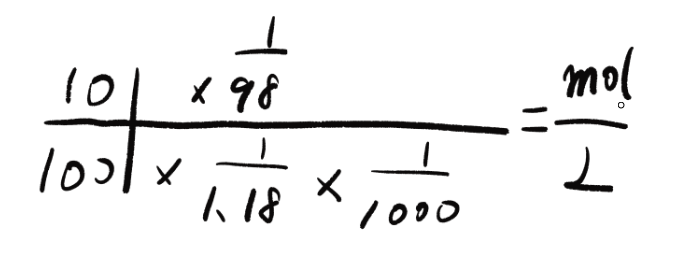
このように答えは1.20mol/Lとなります。
かなり簡単にできたんじゃないでしょうか?あなたはもう脳みそを使わずに計算できますね!一度だけ頭をつかって複雑に考えに考えて間違えやすいやりかたを紹介しておきます。
普通の人がやる問題集の解法
私がネットで見つけたホームページで堂々と公開していた方法です。
==============================================
このように、質量パーセント濃度が与えられて、モル濃度を求める問題の場合・・・
左上のマス(溶液の体積)には1Lと書かれていますから、密度を使って左下のマス(溶液の質量)を求めます。(一応、1L = 1000cm3 ですよ。)
1.18g/cm3 × 1000cm3 = 1180g
次に、質量パーセント濃度が10%なので、右下のマス(溶質の質量)が求まります。
1180g × 0.1 = 118g
最後に、溶質の分子量を使って、右上のマス(溶質の物質量)を求めましょう。
118g ÷ 98g/mol = 1.204・・・
≒1.20molということで、1リットルの水溶液に1.20molの溶質が溶けているわけですから、
モル濃度は1.20mol/Lとなります。
すごく頭を使わなければなりませんよね。しかも、それでいて逆のパターンもあるわけです。
つまり、モル濃度から質量パーセント濃度への変換です。このときはまた考え直しです。めんどくさいです。時間がかかります。
こんな解き方している受験生を哀れみながらあなたは、テンプレートを書いて、『単位を変えるだけ!』ってわかりながら、問題を解く事が出来ます!
このような煩雑さがない骨格を書いた単位変換テクニックは『間違いなく最強!』です。絶対に身につけてください!
ズルすぎるセンター専用の解法テクニック!
この記事では骨格が出来た瞬間に代入をしていますね。ですが、俺はそこで別解を用意します。センター試験または、記述形式ではない、私大や2次試験でも使えます。
はっきり言って、あまりにも考える事をしないので、これだけ覚えるのはヤメてください。
しかし、センターでは確実に使えます。
いや、むしろ使わないとダメです。普通に解くより圧倒的に早くできる単位変換テクニックより圧倒的に早く出来ます。
そんな超ズルい裏計算方法が『公式化』です。
たま〜にこの公式を載せている参考書も在ります。おそらく、ほとんどの人はまだ知らないと思いますが、俺もこれを知ったときに焦りました。
今まで超苦手だった濃度計算が『頼むからセンターで出てくれ!』と思えるようになるほどです。
それではこの公式化について詳しくお話しして行きます。
w%の単位はg(溶質)/g(全)で、
w/100と表せます。
これは先ほども確認しました。
そして、このような骨格を先ほど完成させたと思います。(ちなみにMは分子量です)
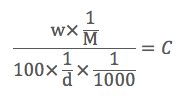
そしてここからがミソなのです。これをどんどん簡略化しましょう。
すると、

これが現れるのです。
どうですか?
これが公式です!
簡単です!
俺が最初に骨格を一般的な文字で作って行ったのには、こういう意味がありました。

上は、w%をCmol/Lに変換する公式で、下は、Cmol/Lをw%に変換する公式です。
2つ覚える必要はありません。1つ覚えていれば、式変形するだけで、簡単にもう1つの公式が作れます。
これのどちらかを唱えまくっていけば、それであなたは簡単にセンターの問題を解く事が出来ます。
これさえ覚えれば、センター試験で濃度変換は、与えられた数値を代入するのみメチャクチャ簡単です。
理論テンプレート集
また今日の記事みたいに、計算を図を書いてほとんど頭を使わずに計算が出来る『テンプレートのようなアイテム』をまとめた無料テキストが在ります!
という俺の無料テキストがあります。
これには、
・気体の分野の混合気体
・熱力学のエネルギー図
などの今回紹介したモノ以外の
理論テンプレートをご紹介してます!
こちらからお受け取りください。
『無料プレゼントを受け取る』















1L=1000立方cmなのでcm3/Lが1/1000になるのではないでしょうか?
分かりにくくなっていますが、
立方センチメートル=mLなので、
mLをLにかえるために1/1000しているとお考えください。
理解出来ました。これでこの方法が実践できそうです。ありがとうございました
わかりにくかったですね!
すみません。
今納得していただいた書き方に変えときますね!
W%=10d分のCMですが、
dは密度
Cはモル濃度
Mはなにを表してますか?
教えてください。
お願いします!
モル質量を表しています。
1モルあたりの質量です。
他のいい方では、原子量、分子量、式量などがあります。
速い回答ありがとうございます!!!
いえいえ、わかりにかったですね!
また気付いたらどんどんコメントお願いします。
合法カンニングペーパーに当てはめた時の変換前の10/100は10が10%の硫酸水溶液の事で100は100%という意味でいいんでしょうか?
あと公式に出てくる10wd/MとcM/10dの10の意味がどこから来てるのかわからないです
定義そのものです。
w%=g(質)/hg(全)だから
まあ簡単に言うと、100g中にwg解けていると言うものが
w%ですから、そのまま書いていると言うわけです。
質問の答えとしては、言いたい事は分かりますが、
そういう意味ではなく、
%濃度の定義なので、10/100と書いているのです。
意味は、g(質)の10、g(全)の100です。
公式は一度自分で解いてみてください。
10が出てくるのが分かります。
10/100は代入後の部分だったんで、それも代入してしまってました。
定義だったんですね。ありがとうございます
10wd/MとcM/10dの意味もやっとわかりました!
今まで1000cm3/Lやw/100をかけていましたが
それをしないでも、密度、質量パーセント濃度、モル濃度がわかっていれば
代入して答えがでるんですね
モルの換算がよくわかりました!ありがとうございます
まだモルの表し方が覚えきれていないのでこれからも頑張りたいと思います
そうなんです。
特に密度の定義が多くの受験生
分かってないんですよね。
密度は分子も分母も(全)
g(全)/mL(全)と言う風に、
両方全なんでg(質)には掛けられないと言う事まで分かりますよね。
計算過程を要求されない問題に是非使いまくって
下さい!
公式のdの単位はなんですか?
密度です
すごすぎます
このやり方で問題解けては!?ってなりましたこんなあっさり解けるなんて……
ありがとうございます!
単位に着目する事はかなり重要です!
硝酸の1.7mol/L水溶液(密度1.05g/cm^3)の質量モル濃度を求めよ。(硝酸の分子量=63)
A,1.8mol/kg
この問題を合法カンニングペーパーの解法で解こうと思ったのですが、掛け合わせ方がわかりません。
教えて下さい。
よろしくお願いします。
それはkg(媒)だからですね。
で、モル濃度は、L(全)ですよね。
だから、L(全)からまずg(全)に変えてから、
g(質)を引かないとダメですね!
質量パーセント濃度80.0%の硫酸水溶液を水で希釈して20.0希硫酸(密度1.14g/cm^3)を200ml作りたい。必要な80.0%硫酸水溶液と加える水の質量は何gか。(原子量、H=1.0 O=16 S=32)
A.80%硫酸水溶液:57.0g 加える水:171g
上の問題を解くときには合法カンニングペーパーの公式化の利用によりどこまで解けるのでしょうか?どの値から手をつけたら良いかわからなくなってしまいます。
%濃度からmol濃度に変えるときですね。
mol(質)/L全を作るように考えると
合法カンニングペーパーよりも
本質的な解法となります。
0.10mol/Lの希硫酸1.0Lつくるには、質量パーセント濃度98%の濃硫酸が何g必要か。
という問題は、どうすれば解けますか?こたえは、10gなんですけど、答えが合いません。教えてください。
硫酸のモルで関連づければ解けます。
mol/L×L=mol
98g(質)/g(全)に必要な濃硫酸xg(全)とおけば、
g(質)がでます。これを分子量でわれば、
molがでますから、
それで両辺を等号で結びましょう!
↓モル利用モル比の考えかたはこちら↓
https://xn--qck0d2a9as2853cudbqy0lc6cfz4a0e7e.xyz/theory/calcule
NH3の水溶液を希釈して6mol/Lの水溶液を50ml作るとき必要なNH3は何ml?(28%、密度0.9g/cm3) これはどのようにしたらいいのですか?
これはモル利用の問題ですね。モルに変換しようと言う風に考えるとわかりやすいです。mol/Lなんだから体積を書けたらmmolが出ます。0.9g/cm3に体積を書けてgにしてそれをモルに変えればいいです。これは濃度変換の問題ではないです。
質量パーセント濃度96、密度1.8の濃硫酸を薄めて2mol/Lの硫酸100mLをつくりたい。何mLの濃硫酸が必要か?という問題はどうやって解けばいいですか?
これはモル利用の問題ですね。モルに変換しようと言う風に考えるとわかりやすいです。mol/Lなんだから体積を書けたらmmolが出ます。1.8g/cm3に体積を書けてgにしてそれをモルに変えればいいです。これは濃度変換の問題ではないです。
ありがとうございます!
密度が0.94g/mlで、質量パーセント濃度が36%のエタノール水溶液のモル濃度を求めよ
この場合、合法カンペにおける変換前はどのように設定するのでしょうか?
36/100となりますね。
返信ありがとうございます
密度を変換前にすると出来ないのでしょうか?
どういう事でしょうか?
密度を変換前というのは?
モル濃度→質%の変換の時は、このカンペの方法は使えないのですか?答えが3650%になります。
使えます。それはおそらく計算ミスです。おそらくmLとLとかのあたりをまちがえているのでは無いでしょうか?
感動してます
濃度換算大っ嫌いだったのに、これなら解けそうです
問題集の解説見ても難しすぎてよくわかってなかったのですが、今度からは解けそうです!
ありがとうございます!
是非使いこなして見てください!
カンニングペーパーで密度の所がcm3/gとなっているのはどうしてですか?
逆数だからです。
納得しました!
使えるように練習します。
頑張ってください!
単位一覧にある質量パーセントについてお聞きしたいことがあります。
質量パーセントとは質量パーセント濃度のことでしょうか?
もしそうでしたら、なぜ分母にhなんですか?
分子にhだと思ってしまいました…。
化学最近始めたばっかでさっぱりわからなくて…。
計算するときは、w%はw/100というように扱わないと計算できないです。
なので、それを意識するために書いています。
わかりにくければ、
g(質)/g(全)で良いと思います。
あ、昨夜のものです。
先ほどこの方法で問題を解いてみたらよくわかりました。
先走ってしまい申し訳ないです。
はじめまして。
2013年度の本試験での問題でお聞きしたいことがあります。
問題: 質量パーセント濃度49%の硫酸水溶液のモル濃度は何mol/Lか。ただし、この硫酸水溶液の密度は1.4g/㎤とする。
どこが間違っているでしょうか。
返信をお待ちしています。
質問: C=W×10d÷M=0.49×10×1.4÷98
=0.07
となり、答えの7mol/Lと合いません。
W%をそのまま代入してください。
つまりwのところが49をそのまま
代入していただけるとそれが答えです!
こういう質問の仕方は非常に良いですね1
モル濃度から質量モル濃度への変換を試みているところですが、すでに質問に上がっていることだったので参考にしたのですがたどり着けず・・・。どうしたらいいのでしょうか?
分母がg(媒)なんですから
g(媒)=g(全)-g(質)
です。
すみません。図があって、「このように、〜になる」ってゆう答えに行き着くまでの道のりがわかりません。代入して、どうしたら1.20mol/Lになるのか教えてください
代入したら、後は数値計算だけだと思うのですが、
数値計算について質問されていますか?
このように1.2mol/lになる計算過程教えてください
L(全)からg(全)にはどう変換すれば良いのでしょうか?
こんばんわ。
自分のワークの問題をといていたのですが、この方法で、モル濃度と密度と分子量から質量パーセント濃度を出せますか??
やってみるとhがどうなるのかわからず、値も合わなかったので質問させていただきました。
あと、最初に設定するものはどうやって決めるのですか??(ここに載っているのならg(質)/g(全)です)
mol/Lから始めれば良いと思います。hは100分のを意味してます。
CuSO4の飽和水溶液の質量パーセント濃度は
10℃で14.5%
60℃で28.5%
60℃のCuSO4飽和水溶液200gを
10℃まで冷却するとCuSO4•5H2Oは最大何g
析出するか。
ただし、CuSO4=160g/mol
CuSO4•5H2O=250g/molとする
という問題でこのページにある方法を解こうとして試行錯誤してみたのですが、答えの56.6gにどうしてもなりませんでした。どういう式を立てれば良いのでしょうか。
このページの問題では在りません。
式の立て方は、こちらのページです。
このページの式の立て方では、厳しいです。
https://xn--qck0d2a9as2853cudbqy0lc6cfz4a0e7e.xyz/theory/solid
132mmol/LのNaCl分子量58.5水溶液の溶質濃度[mg/dl]を答えよ
という問題があったのですがこれに使えますか?
また、使えるとしたらどうやって使えば良いのでしょうか?
自分でやろうとしても出来なかったので教えて下さると幸いです。
まず分子でmmolをmgに変えます分子量で割るだけです。
分母はLからdLにするだけです。1/10にするだけです。
モル濃度はわかりましたが、質量モル濃度への変換の仕方がわかりません。
3.0%過酸化水素(H2O2=34)水溶液の質量モル濃度を求めよという問題なのですが教えていただけますか?
まず質量モル濃度の単位を考えるとmol(質)/kg(媒)なので合法カンニングペーパーの考えから骨格を書くと
g(質)×分子量 mol(質)
ーーーーーーーー
(g(全)-g(質))×10^-3
となり、あとはこれに数値を代入してみると
0.90…となるので0.9となる
分子をg(質)からmolに変えるために、分子を分子量[g/mol]で割ります。そして分母をg(全)からkg(質)に変えるために、g(全)からg(質)を引いてg(媒)にし、k/1000をかけてkg(媒)にします。答えは0.91[mol/kg]です。
mol(A). 1
g(A)×ーーーーー 3×ーー
g(A) 34
ーーーーーーーーー=ーーーーーーー=0.9(mol/kg)
kg(媒) 1
(g(全)-g(A))×ーーー. (100-3)×ーー
g(媒) 1000
この素晴らしい解法をつかって答えを出せても、二次ではこの式を順に記述するだけではだめなのでしょうか?
順番に記述するだけで大丈夫です。
よかったです、ものすごく心強いです。
上の方に関連した質問になるのですが、具体的に記述はどのように書けばいいのですか?
式の羅列だけではまずいでしょうか。
よってとかこれよりとかでいいと思います。
2次試験でこれが大門一つ取ることは多分無いので、
計算式でいいと思います
これは、溶液全般で使えるものですか?
例えば、
標準状態で、470.4Lのアンモニアをすべて、1.0L
の水(水の密度は1.0g/cm3)に溶解させたら、
溶液の密度は0.9g/cm3であった。
アンモニア水のモル濃度はいくらか?
というような問題でも使えますか?
分子分母で単位をつくるという考え方なら余裕で使えます。
こんにちは
重要問題集で上の方の質問と全く同じ場所で手が止まりました。
モル変換前になにをおけばいいのですか?
そもそもこれって、濃度の変換じゃないじゃないですか。
だから、分子分母、別々にmolとLを作ると考えてください
つい先日の模試で以下の問題がありました
ある濃度の硫酸銅(Ⅱ)CuSO4水溶液がある。この水溶液100gを20℃に冷却したところ、25gの硫酸銅(Ⅱ)五水和物CuSO4・5H2Oが析出した。はじめの硫酸銅(Ⅱ)水溶液の質量パーセント濃度は何%か。ただし、20℃におけるCuSO4の溶解度は20g/100g水である
式の立て方がぜんぜんわかりませんでした
質量パーセント濃度は、
a)
g(質・無水)
————-
hg(全)
でなく、
b)
g(質・無水)
———–×100
g(全)
ではないでしょうか?
新研究はb)としているようでした(p151)。
計算用です
このカンペは他の変換、例えば質量モル濃度から質量パーセント濃度への変換みたいな時にも使えますか?
モル濃度から質量パーセント濃度に変換する際に
分子の上のmol→gはg/molをかければいいことは分かりますが、分母部分には何と何を掛けてgに変換すればいいかどのように判断するんですか?どれとどれを組み合わせていいか分からないです
g(溶媒)=g(溶液)ーg(溶質)というシンプルな式で出来ます。
モル濃度のmol/L分母のLに何をかけてgにするんですか?という意味でしたが質量モル濃度と勘違いされてませんか?
密度を掛けてください。
夜分申し訳ありません。質問です。
公式を用いて(c=10wd/m)上記の問題を解いてみると、
10✖️100分の10✖️⒈18 /98となると思うのですが、計算すると10✖️100分の10が打ち消しあって⒈18/98=0.0120408…となりませんか。おそらく僕がどこか間違えていると思うのですが、どうぞよろしくお願いします。
18mol/Lの濃硫酸(密度1.8g/cm³)を50mLとり、水を400g加えた時の質量パーセント濃度は何%か。という問題で、50mLはどこに使えばいいのですか?教えてください!
なかむら先生じゃなくてすみません。。
僕なりに考えたので良かったら参考にしてみてください!
「テンプレートを作る」=「テンプレートに当てはめて色々単位いじくれば答えが出る状態にする」、つまり、「問題文中で行われた操作をすべて行い、あとは単位いじくるだけ!という状態にもっていく」ということだと思います。
なのでまず「操作」を終わらせます。ここで、「モル利用」です。とにかく操作後の状態をモルで表します。なので、少なくとも、文章中の「操作」を、字面でなくイメージすることが必要になると思います。
「1リットルで18モル濃硫酸を50ミリリットルとる」 すなわち
18mol/L×50mL=0.90mol で、これに「水を400g加える。」
つまり、問題文を操作後の状態に書き換えると、「水という溶媒400グラムの中に硫酸という溶質が0.90モルある。この質量%濃度は?」となります。これをテンプレートのスタート地点に書けばいいですよね。ここで使えるのが質量モル濃度「mol(溶質)/kg(溶媒)」です。あとはテンプレートにのっとって解くだけです!
間違ってたら本当にごめんなさい!!!
いつも素晴らしい解法ありがとうございます。
この解法使っていきたいと思ったところ、「濃度変換の問題」と見抜くのがまずできないというか、問題集の「濃度変換」が載ってるあたりを見ても対応できませんでした
この時期になってテンプレートにたどり着きました!計算問題が恐ろしく解けるようになりました!一見複雑に見える文章でも、テンプレートの骨格をイメージしながら読むと、スッキリ読み取れるようになりました。めちゃくちゃ簡単です!
ありがとうございます!!
なぜ1.2mol/lになるんですか
計算過程教えてください
筆算という便利な計算方法を使って計算してみてください。
0.50mol/Lの水酸化ナトリウムNaOH水溶液の密度が1.2g/cm3のとき、この水溶液の質量パーセント濃度は何%か。という問題の解き方を教えていただいてもいいですか?
解法は教えてありますのでそれに当てはめてください。
すみません、、当てはめるところ間違ってて、、
できました。
0.20mol/L硫酸水溶液(密度1.05g/㎝³)の質量パーセント濃度は何パーセントか。という問題ではどういう風に使えますか?
こんにちは。
質量パーセント濃度36%の濃塩酸を用いて、0.50mol/Lの希塩酸1.0Lを作りたい。このときに必要な濃塩酸の体積は何mLか。
(答 42mL)
という問題なのですが、公式に当てはめると、
求めたい体積をXとおくと、
0.5=(10×36×1.2) ÷(0.5÷X)
とおいたのですが、答えの42mLとなりません。
どこが間違っているのか教えていただけると幸いです。
説明したい内容はわかるけど、できん奴に対しては言葉足らずやな。
この文章だけで的確に伝わるとは思えない。
このフィーリングだけみたいな文章で理解できる奴やったら
そもそも二、三行程度の文章で勝手に意図をくみ取ってくれるやろ・・・
つまりターゲット層が不明確。
せやから低レベルな質問が鬼のように押し寄せる。
アンチコメかと思ったら的確すぎて笑いました。ありがとうございます。
9.2gのグリセリンC3H8O3を100gの水に溶解させた水溶液は25度で密度が1.0g/cm3であった。この水溶液中のグリセリンのモル濃度は何mol/Lか。という問題が公式にあてはめても答えがあいません。なぜですか。
質量パーセント濃度8.0%の水酸化ナトリウム水溶液に10ml水を加えて100mlにした。この水溶液のモル濃度はいくつか。水溶液の密度は1.1g/cm3とする。
解き方をテンプレでとくにはどうすればいいですか?
この方法で、逆に密度を求めることはできませんか?質量パーセント濃度とモル濃度と分子量が与えられている場合です。
片方がわかってるだけで求められますが、求める意味がないでしょう。
10mLの食酢を蒸留水で希釈し、100mLにした酢酸25mLを0.12mol/Lの水酸化ナトリウムで滴定したところ15mLを要した。水酸化ナトリウム水溶液と反応する物質が酢酸だけである時、食酢に含まれている酢酸のパーセント濃度はいくつか。
酢酸のモル濃度は
0.025L×x=0.015L×0.12mol/L
を計算して0.072mol/Lになりました。
これを、w=CM/10dの公式にこの問題を濃度変換の公式を使って解くと、どうしても0.1ずれてしまいます。
答えは4.1なのに0.41になってしまいます。
なぜでしょうか。
mLをLに直すときになぜ1000で割るのですか?
毎回1000を掛けてしまいます。
1000ml=1Lだから
0.50mol/lの硫酸20mlにある量のアンモニアを完全吸収させ、残った硫酸を0.50mol/lの水酸化ナトリウム水溶液で中和摘出したところ20mlを要した。吸収されたアンモニアは何gか?(H1.0 N14)