こんにちは。

酸化数を覚えていると、ほとんどの人が無理やり暗記している無機化学で非常に役に立つ『酸化数直線』が使えるようになります。
気体の生成反応や、各族の反応でも理解することで、覚えやすくなります。
なぜ理解すると覚えやすくなるかは、「暗記したことを長期記憶にするために意識する3つのこと」こちらの記事でお話ししています!
なので、確実に酸化数の求め方をマスターしていきましょう!いくつかの例外もありますが、簡単やからとっとと覚えてしまいましょう!
そして、その応用的使い方の『酸化数直線』をキッチリマスターしましょう!
目次
酸化数ってそもそも何?

酸化数 とは
この酸化数とは? という所をすっ飛ばしている参考書が多すぎです。
結構いろんな参考書を読んでいるけど、
「酸化数って物があるから受け入れてね!ちーっす!」
みたいな参考書が多すぎる。
あなたも自分が習っている物が
何なのかくらい分かりたいですよね。
知らんでええからおぼえておけ!って
奴隷みたいじゃないですか?

そもそも酸化数とは何かキッチリ知りましょう。
酸化還元は電子によって定義されています。
こちらの記事にも書きました。
そして、電子式を書いて
電気陰性度を考えれば、
どちらが酸化されたか、
還元されたかが分かります。

これで考えると、
酸素は水素のそれぞれから
電子を一個ずつ貰ってます。
そして、この電子の授受を
分かりやすく数値化した方法が、
酸化数
なのです!
あなたも酸化数のルールは色々
習ったかもしれませんが、
本質はこの電子の授受で
『その原子が貰った電荷』
のことなのです。
だから、この場合で言うと、
水なんかは、
電子を2個得ていますから
酸化数は-2となります。
そして電子を奪われた、
つまり正の電荷を得た水素原子は
それぞれ+1というわけです。
でもいちいち電子式とか書くの
面倒くさいので
酸化数のルールが生まれたのです!
酸化数の求め方と計算法

酸化数 求め方
先ほど述べましたが、
酸化数は電子式を書いて求めるのが、
本質ですが、
毎回毎回電子式を書くのは、
チョーめんどいので
酸化数のルールを覚えて行きます!
酸化数を求めるには、
基準の数値があって、それを覚えることから
始めて行きます。
酸化数を求めるには7つのルールがあり、
それに従って求めていきます。
この7つのルールさえ覚えておけば、
必ず求められるのでキッチリ
身につけていきましょう。
ルール1
『単体のままの状態における酸化数は0である。』
これは例えば塩素Cl2
の場合は、Clの酸化数は0となります。
ルール2
『化合物中に含まれる酸素原子の酸化数は-2である。』
水H2OのOは酸化数は-2になります。
ルール3
『化合物中に含まれる水素原子の酸化数は+1である。』
先ほどと同じ例を使うと水分子
H2Oの水素原子の酸化数は+1となります。
ルール4
『化合物中に含まれる各原子の酸化数の総和した値は0である。』
これも水で考えていきます。
水分子でH原子は+1(ルール3)で、
H原子は2つあるので+2となります。
O原子は−2(ルール2)なので、
+1×2−2=0となります。
このように化合物の酸化数の和は
0になります。
ルール5
『イオンに含まれる各原子の酸化数の総和した値は、イオンの価数に等しい』
例えば水酸化物イオンを考えましょう。
OH–
これは、1価の陰イオンであります。
そして、酸素は化合物中では、
酸化数は-2です。
そして水素は酸化数+1です。
酸化数の総和は、
-2+1=-1です。
これはイオンの価数と同じになりました。
ルール6
『化合物中に含まれるアルカリ金属、アルカリ土類金属の酸化数はそれぞれ+1、+2である。』
NaClのとき、Naの酸化数は、+1となります。
そして化合物中の酸化数の総和は、
0となる(ルール4)があるので、
Clの酸化数は-1となります。
ルール7(例外)
『例外があるから、それは別で覚える。』
H2O2,NaH
この2つの化合物だけは、
計算するとお分かりだと思いますが、
上の6個のルールに当てはまらなくなります。
化合物だから、酸化数の総和0を使うと、
水素の化合物中の酸化数は+1があてはまらなくなったり、
酸素の化合物中の酸化数は−2があてはまらなくなったり、
H2O2の場合は、例外的に
『酸素の酸化数が-1になる』
と覚えておいてください。
またNaHの場合は、
アルカリ金属の化合物中での酸化数が
+1というルールが優先されて、
『水素の酸化数が-1になる』
わけです。
[quads id=5]
例題で慣れる酸化数計算
まだまだ慣れていないので、
例題を解きながら頭に叩き込んでいこう!
次の原子の酸化数を求めよう!
①S
H2S
②S
SO2
③S
CuSO4
④Cu
[Cu(NH3)4]2+
⑤N
NO3–
⑥Cl
KClO3
⑦O
O2
⑧Al
Al3+
⑨Mn
MnCl2
解答
①H2S
これは、酸化数は、
H=+1、S=xとおくと
(+1)×2+x=0より、
x=−2となる。
②SO2
O=-2
S=xとおくと、
x+(-2)×2=0となる
x=+4となる。
③CuSO4
Cu=xとおくと、
SO42-=-2
となる。
x-2=0より、
x=+2
これでCuの酸化数は+2とわかった。
さらに、S=yとおくと、
+2+y+(-2)×4=0
y=+6となる。
④[Cu(NH3)4]2+
$$NH_3$$のような化合物中に含まれる各原子の酸化数を総和した値は0
よって、Cu=xとおいて、
x+0=+2よりCu=+2
⑤NO3–
N=xとおいて、
O=-2だから、
x+(-2)×3=-1
x=+5
⑥KClO3
Kはアルカリ金属であるので
K=+1,O=−2となる。
Cl=xとおくと、
+1+x+(-2)×3=0
よりx=+5
⑦O2
単体のままの状態に置ける酸化数は0です。
⑧Al3+
Al=xとおくと、
x=+3
⑨MnCl2
Clは右端にあるときはClの酸化数を-1とします。
右端にあるときは必ず
Cl–として結合しています。
Mn=x、Cl=-1とおくと、
x+(-1)×2=0
x=+2となります。
酸化数によって理解できること
酸化数が分かることによって、
あることが分かります。
酸化剤にも還元剤にも
慣れる物質があるんですけど、
これってなんでなんですか?
例えば、
SO2
は両方になれますよね。
でも、なんで
H2S
は還元剤にしかなれないんですか?
めずらしくいい質問だな!
これはこの記事で
酸化数を理解したよな。
これをつかった
『酸化数直線』を使えば、
一発で分かるんだ!
他にも
SO2は基本的に還元剤なんだが、
どういうときに酸化剤として働くか
もわかる!
この酸化数直線を使えば、
無機化学でも役に立つから絶対に
理解してくれ!
SO2からみていきましょう!
こいつの半反応式はこのようになります。

二酸化硫黄の半反応式
なんで、同じ硫黄を使っているのに、
硫化水素や、熱濃硫酸は、
還元剤のみや酸化剤のみなのでしょうか?
それを考えるためにまず、
それぞれの酸化数を求めてみます!
分かりやすくするために
酸化数が小さい順番に
並べてみるとします!
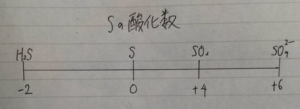
硫黄Sの酸化数直線
このようにある原子の
酸化数を数直線のように並べたものを
『酸化数直線』と言います!
これを見たら、
端っこの酸化数が-2と+6になっていますね。
SO62-とかやれば酸化数は+10とか
までいきそうだし、
H6Sとかがあれば、酸化数は-6とかに
なりそうな気もする。
でも端が-2から+6になるのは理由があります。
まずは硫黄Sの電子式を見てください。

硫黄の電子式
硫黄の価電子は6個
よって閉殻(オクテット)まであと2個
電子を受け取ることが出来ます。
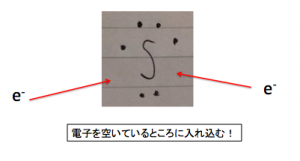
硫黄Sの電子式
このように電子を入れ籠みます。
すると、
S2-
になります。
言い方を変えれば
S2-までにしかなれないのです。
よって酸化数の最小値は-2となります
これを最小酸化数
と言います。
また硫黄Sから電子を奪うとしたら、
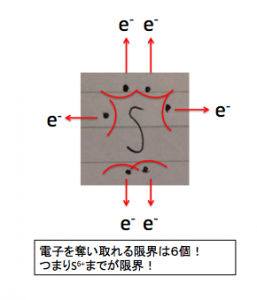
硫黄S電子奪い取り
価電子は6個なので6個までしか奪えません。
S6+までなので、
酸化数の最大は+6です。
これを最大酸化数と言います。

硫黄Sの酸化数直線
そしてもう一度この数直線を
みてもらうと、
幅が8だとわかります
なぜなら+6ー(ー2)=8ですよね
これはもちろんですが、
閉殻構造の電子の数8です。
そして数直線の限界が分かったところで、
薄々気付きだしている人も居るはずです。

硫黄Sの酸化数直線
なぜ、二酸化硫黄が酸化剤にも還元剤にも
なれて、硫化水素や熱濃硫酸がなれないのか。
それは、『硫化水素と熱濃硫酸は酸化数直線の端、崖っぷちだから』となります。
そして二酸化硫黄が両方になれるのは、『端っこじゃなくて右にも左にも行けるから』です。

酸化還元の定義
酸化還元の酸化数の定義は上になります。
よって、
酸化数直線を右に行くと酸化される
つまり、相手を還元するから還元剤!
となります。
SO2
それでは酸化剤と還元剤になれる
SO2についてお話ししていきます。
二酸化硫黄は、普通右端の
酸化数+6に近づきたがります。

硫黄の酸化数直線
つまり、普通は『還元剤』として
働きます。
ですが、時々左向きに酸化数を減らして
酸化剤として働きます。
それは、
『相手が酸化数直線の左端』
のときです。
例えば、この酸化数直線ならば、
$$H_2S$$
などと反応するときは、
酸化剤として左側に向かいます。
H2O2
この過酸化水素もどちらにもなれますね!
ということで、
酸素に関する酸化数直線を書くと、

酸素の酸化数直線
過酸化水素水は基本的に
酸化剤として働きます!
基本的には左向きに酸化数は移動します。
ですが、
右向きに移動して
『還元剤』で働くこともあります。
それは相手が『左向き』に
移動するしか無い、
最大酸化数の相手との酸化還元反応の
時です。
例えばKMnO4,K2Cr2O7などです。
これらは超強力な酸化力をもつ酸化剤で、酸化数直線の右端に居ます。
なので、酸化剤になるしか無いのです。そういうときは、過酸化水素も仕方なく還元剤として働きます。

















とてもわかりやすかったです!
ありがとうございました
ありがとうございます!
SO2
のところで
酸化数直線で時々、左向きに向かったら還元剤ではなく酸化剤になりますよね?
説明とてもわかりやすかったです
今の部分だけが少し疑問に思いました
ご指摘ありがとうございます!ミスです!
修正いたしました。
ありがとうございます!
本当に助かります!
分かりやすかったです!
酸化数のルール⑥のNaClの問題のところなのですが…
Clがアルカリ金属なので、+1になり、
Naが-1になると思います。
ワタナベ先生じゃなくて申し訳ありません○┓
塩素原子Clは17族のハロゲン元素では?(周期表でご確認ください。)
よって⑥のルールは正しいです!
部外者がすみませんでした!
その通りです。ありがとうございます。
問題で出てきたのですが
SnCl2の場合
アルカリ金属、アルカリ土類金属が無くてもClの酸化数は-1として良いのでしょうか?
OKです。
アルカリ金属がないと-1にできないなんてルールはありません。
オッケーです。
数直線の長さって|8|以下になるってことですか?
もしそうなら、二クロム酸カリウムの酸素の酸化数って−14になるのはどういうことですか?
酸素の酸化数は-2です。
酸化数のルールを確認し直してください。
酸化数を考えるのはクロムです。
わかりやすく、少し苦手を克服できそうです。この調子で頑張ります!ありがとうございました!!!!!(❁´ω`❁)
控えめに言って神
ありがとうございます!
SO2が基本還元剤としてはたらく理由はなんですか?
酸化数的に還元剤になれるから
とても分かりやすかったです。とくに酸化数直線は便利なツールですね。
ところで質問なのですが、SO2 が酸化数直線の右側に行きたがるのは、そちらの方が近いですしなんとなく理解できます。
しかし、H2O2 は何故基本的には左向きに移動するのでしょうか?
水の方が安定だからです。
酸素よりも水がエネルギー図で下の方に位置します。
エネルギー図が下ということは、安定を意味します。
↓エネルギー図の順番の覚え方が書かれているのでこちらを参考にしてみてください。
https://xn--qck0d2a9as2853cudbqy0lc6cfz4a0e7e.xyz/theory/energyzu