こんにちは。
早速ですが、こんな質問が来たんですよ。

こういう質問に対して、違和感を覚えました。
というのも、固体の溶解度の問題は一切場合分けをしたことがなくて、全て全く同じ方法で解いていたからです。
僕は水和水だからと言って、特別な解法を使ったりしません。ただただワンパターンに公式に当てはめているだけです。
もしかしたら、
- 水和物があるパターン
- 水を蒸発させるパターン
- 温度を下げて蒸発させるパターン
このように、いろんなパターンを覚えさせられているかもしれません。
もしそうならかなり微妙です。僕は高校2年生から今の今まで化学をやっていますが、全く固体の溶解度を覚えようと思ったことがありません。
なぜなら、
- 意味がない
- 応用が効かなくなる
という、残念な結果になってしまうからです。
もしかすると、固体の溶解度に苦手意識があり、難しいと感じる人は、いろんなパターンを覚えすぎているからです。
本記事で話す「たった1つの解法」で攻めれば、「固体の溶解度が難しい」なんて思うはずがありません。ムッチャ簡単な分野の1つです。覚えることが少なくて済みます。応用も効きます。
↓この問題で解説していきます。まずは一旦自分で裏紙にでもいいので、今の自分の解き方で解いてみてくださいね。
水100gにたいするNaNO3の溶解度は80℃150、20℃88とする
(1)80℃の飽和溶液100gを20℃に冷却したとき何gNaNO3が析出するか?
(2)(1)の溶液から水が20g蒸発したとき何gNaNO3が析出するか?
それでは参りましょう。
※この記事は問題を解きながらやることがめちゃくちゃおススメです。なので10分ほどかかります。時間がない人は、まず4分ほどでこの記事を読み、あとでじっくり解くためにブックマークしておくことをオススメします。
目次
固体の溶解度の計算問題はたった1つの解法しか使いません

固体の溶解度は、たった1つの解法だけで解き切ることができます。
それが、変化後の飽和溶液の溶解度で関係式を作ることです。
飽和溶液ということは溶けられるギリギリまで溶けている状態です。てことは、その温度の溶解度ギリギリになっているということです。
このことを使って問題を解いていきます。
固体の溶解度の解法は4ステップで解けます。めっちゃ簡単です。それではこの固体の溶解度の解法を完全レクチャーして行きましょう!
ステップ1:最終状態の温度と溶解度を確認
ステップ2:最初の溶質(無水物)と水の質量を求める
ステップ3:変化量を求める
ステップ4:変化後の溶液の飽和溶液で関係式を作る
この4ステップで固体の溶解度の計算問題の答えは全て求めることができます。
この時重要なのが、溶解度の単位をしっかり把握することです。溶解度の単位はこちらです。

重要なのは、溶質が無水物であることです。この単位をしっかり覚えておくだけで、水和物を分けて考える必要がなくなります。
また、溶媒は、大抵水の100gです。
では、具体的に問題にこの解法を当てはめていきますね。
固体の溶解度の問題の計算問題を実際に解いてみた
水100gに対するNaNO3の溶解度は80℃150、20℃88とする
(1)80℃の飽和溶液100gを20℃に冷却したとき何gNaNO3が析出するか?
(2)(1)の溶液から水が20g蒸発したとき何gNaNO3が析出するか?
まずは、この問題がどのような状態になっているのかを確認します。
(1)で80℃の飽和溶液を20℃まで冷却します。
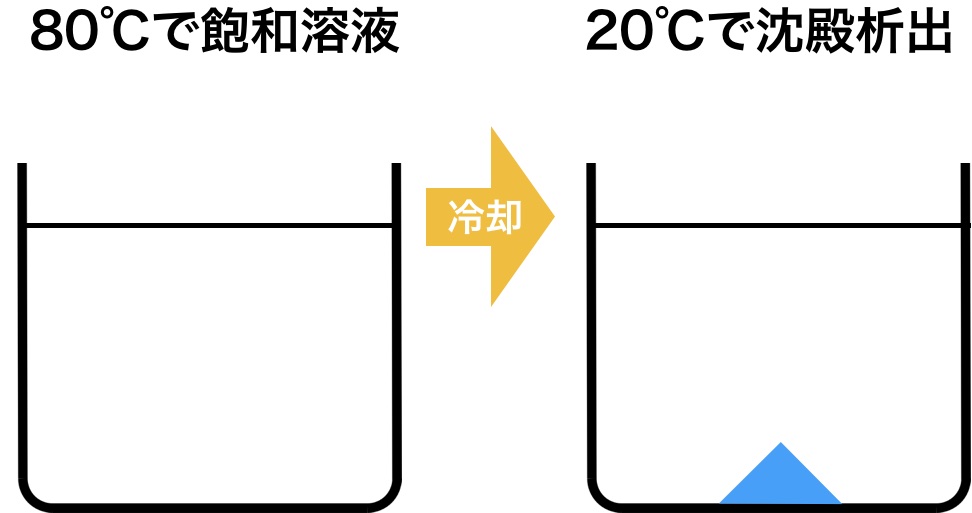
このように温度が60℃ほど下げられると、溶けきれなくなった硝酸ナトリウムが析出してきます。
(2)で20℃まで冷却したものから水を20g蒸発させます。
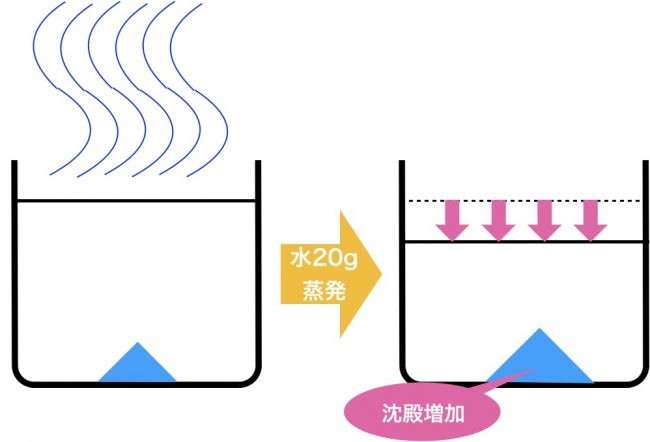
このような問題の設定を解いていきます。そして、先程の解法を完全に当てはめていきますね。
ステップ1:変化後の温度と溶解度を確認
ステップ2:最初の溶質(無水物)と水の質量を求める
ステップ3:変化量を求めて1、2を表にまとめる
ステップ4:変化後の溶液の飽和溶液で関係式を作る
(1)を解いていく
途中で

って思ったとしてもそのまま突き進んでください。途中で説明を加えていますし、最終的に全てのステップが終わったらもう一度まとめ直します。
ステップ1:変化後の温度と溶解度を確認

この状態ですので、変化後は、温度が20度であり、溶解度は88g/100gです。
ステップ2:最初の溶質(無水物)と水の質量を求める

最初の溶液で溶けている溶質(無水物)の質量を求めていきます。
飽和溶液全体が100gです。この中の溶質の割合は、

です。
逆に水の割合は、

です。溶解度が150とは、水100gに溶質が150g溶けるということなので、飽和溶液250gのうち、150gが溶質であり、100gが水という割合です。
今回は、溶液全体が100gなので、この割合を掛ければいいのです。


ここまでオッケーでしょうか?
何を求めるために、ここまで求めてきたのかわかってますか?
変化後の飽和溶液の溶解度で関係式を作るためでした。一応さっき言ったことでしたが、多分忘れていると思うので、もう一度。
これを意識していくと、ステップ3、ステップ4がよくわかります。
ステップ3:変化量を求める

80℃から20℃まで冷却した時の変化としましては、溶質が析出する変化が起こっていますね。
溶媒の水は特に変わっていません。なので、上の画像のように、析出した溶質の質量をx[g]とおきます。
こうすると、表にまとめることができます。(表にまとめた方がなお良い)

ここまできたら、チェックメイトです。
ステップ4:変化後の溶液の飽和溶液で関係式を作る
変化後の飽和溶液と溶解度を等式でつなぐ

これが変化後の溶液の様子ですが、この溶液は析出するということでもう溶けきれない状態の飽和溶液です。
なので、飽和しているので、溶ける限界ということです。つまり溶解度のマックス状態です。
よって、変化後の溶液は溶解度と等号を結ぶことができるのです。

このようになります。よって、答えはx=24.8[g]です。
析出した沈殿は24.8[g]です。
分母を溶媒の水ではなく、溶液の質量にするやり方を習った人もいるかもしれません。結論どっちでもいいですが、計算の面倒は変わりません。
でも、そういうこともあるんだと心得ておくことで、心配になりすぎずに次に進めます。
固体の溶解度の計算問題の解法のまとめ
[img]結局のところ何をしているか?
変化後の飽和溶液の溶質の質量と溶媒の水の割合=その温度の溶解度
この式を立てるだけなんです。
ですが、これだけをいうと、途中で何をしたらいいのかわからなくなるので4ステップにわけちゃいました。
てな訳で、これで全ての問題を解けるようになります。
ここまでは、比較的簡単な問題でまずは解法を確認してもらいました。
固体の溶解度の解法をいろんなパターンの問題に当てはめてみた
[img]ちなみに、今の例題でも雑魚参考書や雑魚サイトには、「溶液を冷却して析出するパターン」みたいな分け方がされています。
でも、そんなこと考える方がおかしいですよね。次は、
「水和物が析出される場合」「途中で加熱される場合」の2つです。
ですが、パターンを覚えるのではなく、最初に学んだ解法を当てはめていくイメージです。
水和物が析出される場合はどうする?
60℃における無水硫酸銅(II)の水に対する溶解度を40.0(g/100g水)、また、20℃に置ける溶解度を20.0(g/100g水)とする。60℃における飽和水溶液140gを20℃に放置すると、硫酸銅(II)五水和物の結晶が析出した。析出した硫酸銅(II)五水和物は何gか。有効数字2桁で答えよ。ただし必要な場合には、次の値を用いよ。
原子量:H=1.00,O=16.0,S=32.1,Cu=63.5
九大
実際旧帝国大学でも出題されている問題ですね。水和物で出題されるのは、大抵硫酸銅五水和物ですね。
硫酸銅の結晶には、1つの硫酸銅あたりに5分子の水分子が結合しています。これによって、溶解度の計算が若干ややこしくなるのですが、別に何も問題はありません。
ステップ1:最終状態の温度と溶解度を確認
ステップ2:最初の溶質(無水物)と水の質量を求める
ステップ3:変化量を求めて1、2を表にまとめる
ステップ4:変化後の溶液の飽和溶液で関係式を作る
この解法を当てはめていくだけです。
水和物の計算問題の解法はこちらの記事で解説しております。
途中で加熱して溶媒の水が減った場合
KNO3の溶解度は80℃で169、60℃で110、20℃で31.6である。次の問いに答えよ。
60℃のKNO3飽和溶液1050gをとり、60℃の状態で840gになるまで水分を蒸発させると何gの結晶が析出するか。
例えば、こういう問題ですよね。

このような状況です。温度変化はないものの、水が蒸発することで溶けられる溶質の量も減るって状況です。
このパターンももちろん今回の記事で学んだノウハウで解けます。
あまりにもこの記事が長くなりすぎるので、こちらの記事で解説しています。
ちなみに、一番最初の例題の(2)でも同じパターンの問題が出ています。
水が減ると言う事は、その減った分の水に解けていた溶質が析出する事は不可避ですぞ!
最後に「再確認!」
ここまで読んでどうでしたか?
多分、固体の溶解度の解法でつまづいていた人は、その問題ごとにいろんな解法を覚えようとしすぎていたからなんですよ。
固体の溶解度ってめちゃくちゃシンプルです。
- 単位を正確に覚える
- 変化後の飽和溶液と溶解度を等号で結ぶ
たった、これだけですね。














こちらのメールから失礼します。
先生の溶解度の問題の解き方のページ拝見させていただきました。質問なのですが
解くときに初めの溶質と水の質量を求める時に(大問1)では100を(大問2)では140をかけていますがどこをみれてその数字なのですか?基本中の基本かもしれませんがそこで今日つまづきました。お願いします。
動画見直したらわかりました。ありがとうございました。
お、大丈夫でしたか!
飽和溶液の溶質=溶液全体の質量×溶解度/溶液全体(=水+溶質)
なので、です!
動画のここに
https://youtu.be/unhA0K3Xv5I?t=3m17s
載せておきます!
固体の溶解度!
色々な解法があったので本当に迷っていました!
予備校では結晶水を一発で出す方法とか、
色々覚えないと行けないのかと思って
頭ぐちゃぐちゃになっていたのですが、
本当にすっきりしました!
学校では、ここまで計算方法まで教えてくれないので本当に助かっています!
ありがとうございます!
がんばってください!
水和の析出問題・九大(ビデオ) について、
どうしても答えが35.211、、になります。
どうしてだろう、、。
最終的に20-0.072X=40-0.64X という式になりました。
いつも溶解度の問題はその場その場で考えて解いていたけど、初めの溶媒溶質を出して変化量をxとおいて最後の溶解度に代入。という風に解法がシンプルで凄く分かりやすかったです!
水和物の問題もこの方法でやってみると楽勝に解けました!
そうですね1シンプルじゃないとむしろこの分野はきびしいですね。
初めて回答を見ずに五水和物の問題が解けました!感動です!
分かりやすい説明ありがとうございます(*^o^*)
本当ですか!
いいですね!これからも頑張って書きます。
お互い頑張りましょう!!
CuSO4の溶解度は20℃で20g/100g水
20℃でCuSO4・5H2Oは20℃で150gの水に何g溶けるか
溶解度20g/100g水より
150gの水に溶けるCuSO4は30g
よって溶けるCuSO4・5H2Oは
30×250/160=・・・
としたら答えと違っていました。
何が違ってどのように解けば良いのでしょう?
5水和物の5H2Oが溶媒に増えているから答えが違うのだと思います。
こんばんは。
水和物のところに書いてある、九大の問題は、重要問題集のp40の81番と同じ問題ですか?
同じ解き方でやろうとしたのに、重問の(2)の答えが等しくなりません。
硫酸銅、硫酸銅五水和物の式量(?)はそれぞれ160,250にして計算しました。
かなり前にとったのであまり覚えていませんが、160と250では無かった気がします。それで外れているのでは?
学校で教わるより分かりやすかったです!ありがとうございました!
ありがとうございます!是非ガンガン活用していってください!
わかりやすい解説ありがとうございます。
全くわからなかったのにあっという間に出来るようになりました!
ついでに気になったのですが硫酸銅(Ⅱ)五水和物の動画の方、159.6×5の計算ミスではないでしょうか?
本当ですか。すみません。
溶解度の問題がハナクソに見えるようになりました、ありがとうございます!
ハナクソw
素晴らしいです(笑)
水を完全に蒸発させたときに分母が0になってしまうのですが、どうすればいいでしょうか?
それは溶解度の問題ですか?「
20℃の硝酸カリウムの飽和水溶液200グラムから水を完全に蒸発させると、何グラムの結晶が得られるか?
(20℃の水100グラムに対する溶解度30グラム)
という問題です。
この問題で蒸発させることは特に大きな意味はありません。
蒸発させる前の飽和水溶液に何g解けているのですか?と聞かれているだけです
あっ、そういうことだったんですね!
忙しい中わざわざありがとうございましたm(_ _)m
質問です
一つ目の問題の1番で左辺は88/100となっているのに
右辺が150/100+150となるのがよくわかりません。
150/100ではいけないのですか?
それとも100グラムの水に対する溶けている割合ということですか?
お忙しい中すみません
質問があります
水溶液が飽和水溶液出ない場合どうすればいいですか
すみません誤変換してました
「飽和水溶液ではない時」です
上の問題は水溶液を冷却した時の析出量を求める問題と、その後さらに水を蒸発させた時の析出量を求める問題ですが、初めに水溶液を加熱して濃縮した後に冷却する問題はどう解けばいいですか?
冷却して再結晶を得る場合に、
例えば硝酸カリウム(40℃で64g、20℃で32g)の時、
どうして、
飽和水溶液200gに直して、それぞれ飽和水溶液200gに解ける量をxとyにおいてから
64/164=x/200と32/132=y/200から
xとyを求めて引き算してはダメなんですか?
この分野捨てようかと思ってたけどようやく納得のいくサイトに出会えた
ありがとうございます。
ずっと固体の溶解度が苦手だったのですが、おかげでだいぶ分かるようになりました。
感謝です。