こんにちは。
酸化還元では、電池の原理とか
最頻出の鉛蓄電池の
受験テクニックに関して
お話ししてきましたね。
今回『ボルタ電池』という超基本的な電池を扱います。ボルタ電池は特に、もっとも最初の電池と言われています。
物理で絶対出てくる電圧V[ボルト]の由来となった人、ボルタが世界で始めて作った電池です。

とはいえ、ボルタ電池には、致命的な欠陥がありました。
そして、それを補うためのものとして、『ダニエル電池』が発明されました。

ボルタ電池の欠陥をうまく避けている構造になっていてます。
ダニエル電池はこの記事では扱いませんが、今回はダニエル電池の基本でもある、ボルタ電池を徹底的にまなんでいただこうと思います。
目次
電池の注意
電池の極板に関してよく、
受験生の誤解を生む記述が
見られます。
でも書きましたが、
電池をイオン化傾向だけで語るのは、
無理があります。
まあよくある、こととして、
負極がイオン化傾向大きいもの、
正極がイオン化傾向小さいもの、
と習うと思いますが、
この覚え方だと、
金属じゃなかったときに、
どうしたら良いかわからなくなります。
なので、
負極=還元剤
正極=酸化剤
と覚えましょう!
これだとイオン化傾向が
大きい方が、
イオン化しやすい=電子を投げやすい
=還元剤と
イオン化傾向の定義も
含む事が出来ます!
極板が、金属じゃなくなる事も
入試問題であるので、
そこでつまらないようにしておいてください。
それではこれを理解してボルタ電池の
内容を頑張って行きましょう!
ボルタ電池の原理
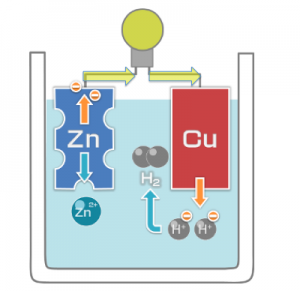
負極に亜鉛Zn、正極に銅Cuで
出来ている電池です。
原理
電池の原理は、
『離す』『つなぐ』『電解質』
でした。
で、今回の電解質は、
『濃硫酸』です。
イオン化傾向が大きいZnは
Cuより電子を投げやすいので、
負極になります。
負極から正極に電子が流れる
=正極から負極に電流が流れる
と言う事になります。
ボルタ電池の画像
この画像のように、
黄色矢印の向きに電子が
流れて行きます!
ボルタ電池の流れ
ボルタ電池は次のような流れで、
反応して行きます。
ステップ①
亜鉛Znが酸化されて亜鉛イオンZn2+に
なり、電子を投げる!
半反応式は、
Zn→Zn2++2e–
ステップ②
放出された電子は銅線を通って
Cuに流れる!
ステップ③
銅は陰イオンにならないので、
溶液中に電子を貰える奴を探す。
すると、硫酸が電離していた、
H+がいた。
2H++2e–→H2
と電子を受け取って
還元されてH2が生成
されます。
ボルタ電池の反応式
今までのステップを電池式に表すと、
次のようになります。
また、この電池全体の反応式は、
半反応式を組み合わせて、
Zn+2H+→Zn2++H2
化学反応式にすると
Zn+H2SO4→ZnSO4+H2
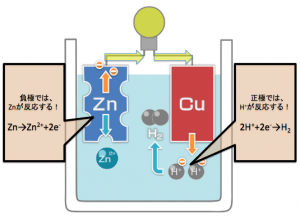
ボルタ電池の反応まとめ
ボルタ電池をまとめると、
負極では,
Zn→Zn2++2e–
正極では、
2H++2e–→H2
となる。
電池全体では、
Zn+H2SO4→ZnSO4+H2
の反応をします。
ボルタ電池の欠点とは?
世界で初めて作られた
電池だけにやはり、欠点、課題も
ありました。
それは、分極と言う現象で、
電池の起電力が下がる事です。
(※起電力とは電流(電子)を長そうとするエネルギー)
(電圧と同義)
ボルタ電池の起電力は、
1.1Vくらいですが、
電池の反応が進むと、
0.4Vくらいにまで下がります。
分極の原因は?
ボルタ電池の起電力を下げる、
分極と言う現象ですが、
この原因は、正極で発生する
H2が原因です。
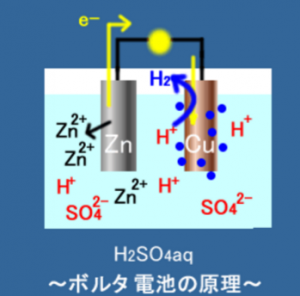
この画像のように、
発生した水素が陽極にまとわりついている
わけです。
(●が水素)
で、正極の反応って、
イオン中のH+が
e–を得る事で、
正極の役割を果たしていました。
まとわりついたH2
のせいで、液中のH+が
電子を受け取りにくくなります。
正極はちゃんと電子を受け取る
必要があります。
なぜなら、負極がどんどん電子を
投げてくるのに、
正極が電子受け取らなかったら、
「なるほど、ちょっと投げるの緩めよか、」
ってなりますよね。
そうすると、
電子を投げようとする力、
起電力が小さくなるのは、
当然ですよね!
ボルタ電池の欠点の解決方法は?
じゃあこの欠点をどうやって
解決するのか?
気になるところですよね。
解決したいポイントは1つ。
水素を発生させたくない!
じゃあこれをするためには、
H+が直接電子を
受け取らないようにすれば良いのです。
そう、酸化剤を変えてやれば
良いのです!
正極には、電子を受け取るために、
なにかしらの酸化剤が必要です。
そしてそれによく使われるのが、
『過酸化水素』です。
過酸化水素は、
H2O2で
酸化剤としても還元剤としても
働く事が出来ます。
そして、酸化剤として働くとき、
H2O2+2H++2e–→2H2O
となり、水が生成します。
すると、
分極を起こす水素は発生しません!
これにより、起電力の低下を
大幅に抑える事が出来ます。
このような役割をする、
過酸化水素のことを、
『減極剤』と言います。
最後に
ボルタ電池はどうでしたか?反応的には簡単でしたが、色々な問題もあり、減極剤の件も記述で狙われます。きっちり復習しておいてください。
また、次にボルタ電池を改良し、初めて実用的な電池となったダニエル電池についても必ず勉強しておきましょう。















スマホでメルマガ登録したのですが。
スマホでダウンロードした合法カンニングペーパーや化学テンプレートがスマホでみると表示されない文字があるのかうまく表示されません。パソコンでみようと試みたのですがログイン的な画面が見当たりません。あるのでしょうか?
ないですよ〜
パソコンでも見られます!
でももう一回メルマガ登録してーみたいなのが出て、スマホの方で登録してあるのを打ったら使われてるからダメだと言われました。これはまた別のメアドを打たなければいけないのですか?
まあ、URLを打ち込んだり、
自分のパソコンのメールアドレスに転送すれば
良いと思います。
ボルタ電池において、Cuは酸化剤になっていないですよね?この場合は電解質である硫酸が酸化剤になっているのですか?
またそのように考えたときにダニエル電池の正極の反応がうまく理解できません。合わせてお願いします。
酸化剤が水素イオンです。
硫酸が酸化剤となるのは、『熱濃硫酸』になったときだけです。
ダニエルすごい。何度も勉強してところのはずなのに新鮮。酸化還元とか分極とか基礎かー。と再認識です。ありがとうございます。
このページでで確認したあと動画で復習するとめっちゃわかりやすいです!
電子が流れるとH2SO4 が使われてH2Oが増える、つまりH2SO4 の濃度と密度が減ることが重要なんですね!
多分それは鉛蓄電池の話ですが、鉛蓄電池の話でしたらそうです。
最初、ボルタ電池は、正極でCuOとH+が反応してCuとH2Oが生成する。CuOが反応し終わり、そこでCuとZnの電池となる。CuとZnの電池はCu板でH2を発生されるのにエネルギーを使うため、起電力が低下。よって、この切り替わりの際に起電力が低下する。このことを分極と呼び、このサイトで書かれているのと同様な説明が間違っていると聞いたのですが、何を信じるべきですか?
受験化学での正解を書いたまでです。
なぜZnが陽イオンになった時に放たれた電子はそのままHイオンと反応する前に銅線に流れていくんですか?
一部は反応しますよ。よって分極ですよね。
電解質をアルカリにしたるのはどうですか